Diferencia entre revisiones de «Interacción dipolo-dipolo»
Revertidos los cambios de 190.3.194.222 a la última edición de UA31 |
|||
| Línea 9: | Línea 9: | ||
Los '''enlaces entre dipolos permanentes''' ocurren entre moléculas que tienen un momento dipolar intrínseco; esto habitualmente se puede relacionar con una diferencia de [[electronegatividad]]. Por otro lado, los átomos y las moléculas apolares, que no tienen un momento dipolar permanente, son [[polarizabilidad|polarizables]], esto es, pueden formar dipolos eléctricos como reacción a un [[campo eléctrico]] cercano. El enlace entre un átomo o molécula apolar y una molécula dipolar se denomina '''dipolo permanente-dipolo inducido''', y es de alcance aún más corto. |
Los '''enlaces entre dipolos permanentes''' ocurren entre moléculas que tienen un momento dipolar intrínseco; esto habitualmente se puede relacionar con una diferencia de [[electronegatividad]]. Por otro lado, los átomos y las moléculas apolares, que no tienen un momento dipolar permanente, son [[polarizabilidad|polarizables]], esto es, pueden formar dipolos eléctricos como reacción a un [[campo eléctrico]] cercano. El enlace entre un átomo o molécula apolar y una molécula dipolar se denomina '''dipolo permanente-dipolo inducido''', y es de alcance aún más corto. |
||
jac |
|||
== Referencias == |
== Referencias == |
||
Revisión del 18:59 3 feb 2013
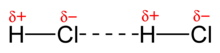
La interacción dipolo-dipolo consiste en la atracción electrostática entre el extremo positivo de una molécula polar y el negativo de otra. El enlace de hidrógeno es un tipo especial de interacción dipolo-dipolo.
Las fuerzas electrostáticas entre dos iones disminuyen de acuerdo con un factor 1/d2 a medida que aumenta su separación d. En cambio, las fuerzas dipolo dipolo varían según 1/d3 (d elevado a la tercera potencia) y sólo son eficaces a distancias muy cortas; además son fuerzas más débiles que en el caso ion-ion porque q+ y q- representan cargas parciales. Las energías promedio de las interacciones dipolo dipolo son aproximadamente 4 kJ por mol, en contraste con los valores promedio para energías características de tipo iónico y de enlace covalente (~400 kJ por mol).
Estas son ligeramente direccionales, es decir, al elevarse la temperatura, el movimiento transicional, rotacional y vibracional de las moléculas aumenta y produce orientación mas aleatoria entre ellas. En consecuencia, la fuerza de las interacciones dipolo-dipolo disminuye al aumentar la temperatura.
Tipos de enlace dipolo-dipolo
Los enlaces entre dipolos permanentes ocurren entre moléculas que tienen un momento dipolar intrínseco; esto habitualmente se puede relacionar con una diferencia de electronegatividad. Por otro lado, los átomos y las moléculas apolares, que no tienen un momento dipolar permanente, son polarizables, esto es, pueden formar dipolos eléctricos como reacción a un campo eléctrico cercano. El enlace entre un átomo o molécula apolar y una molécula dipolar se denomina dipolo permanente-dipolo inducido, y es de alcance aún más corto.
jac
Referencias
- Química general, Kenneth W. Whitten, tercera edición.
