Inmunoglobulina M
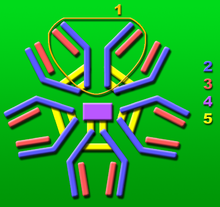
La inmunoglobulina M (IgM) es uno de los cinco isotipos de inmunoglobulina (G, A, M, E, D) presentes en mamíferos, constituyendo un 6% de la población presente en sangre. También se encuentra presente en elasmobranquios, teleósteos, anfibios, reptiles y aves, siendo uno de los anticuerpos más antiguos en la historia evolutiva.[1] Se denomina también macroglobulina (de ahí el nombre de la enfermedad en la que se presenta exceso, macroglobulinemia de Waldenström) debido a su tamaño: es la inmunoglobulina más grande (950.000 Daltons),[2] aunque el tamaño no se debe exclusivamente al peso molecular real de la molécula, sino que ésta presenta la capacidad, a través de su región Fc, de interaccionar con otras cuatro moléculas de IgM, formando un complejo de alto peso molecular de cinco moléculas de IgM.
La capacidad de la IgM para formar estos complejos -lo cual le da gran facilidad para unir el complemento- es la que le da el poder de opsonizar determinados antígenos, provocando la lisis de bacterias, envueltas víricas y otros agentes patógenos. Es el primer tipo de inmunoglobulina sintetizada en respuesta a una infección.
Véase también
- Anticuerpos
- IgE, IgA, IgD, IgG
Referencias
- ↑ Regueiro Gonzalez, J. R. 2011. "Inmunología: Biología y patología del sistema inmunitario", 4.ª edición. Panamericana, Madrid. ISBN 978-84-9835-003-6
- ↑ Devlin, T. M. 2004. Bioquímica, 4.ª edición. Reverté, Barcelona. ISBN 84-291-7208-4
