Imagen de fluorescencias

Las imágenes de fluorescencias son un tipo de técnica de imagen no invasiva que puede ayudar a visualizar los procesos biológicos que tienen lugar en un organismo vivo. Las imágenes se pueden producir a partir de varios métodos que incluyen: microscopía, sondas de imagen o espectroscopía.
La fluorescencia en sí misma es una forma de luminiscencia, resulta de la materia que emite luz de una cierta longitud de onda después de absorber al radiación electromagnética. Las moléculas que vuelven a emitir luz tras la absorción de luz se denominan fluoróforos.[1][2]
Las imágenes de fluorescencia se obtienen mediante fotografías digitales de muestras con tintes fluorescentes y proteínas fluorescentes para marcar estructuras y mecanismos moleculares. Permite observar experimentalmente la dinámica de la expresión génica, la expresión de proteínas y las interacciones moleculares en una célula viva.[3] Esencialmente sirve como una herramienta cuantitativa precisa con respecto a las aplicaciones bioquímicas.
Hay una confusión de conceptos erróneos al respecto que se suele cometer: la fluorescencia difiere de la bioluminiscencia en cómo las proteínas de cada proceso producen luz. La bioluminiscencia es un proceso químico en el que las enzimas descomponen un sustrato para producir luz. La fluorescencia es la excitación física de un electrón, y su posterior retorno a emitir luz.
Atributos[editar]
Mecanismo de fluorescencia[editar]
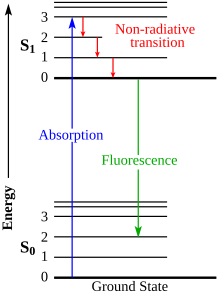
Cuando una molécula determinada absorbe luz, la energía de la molécula se eleva brevemente a un estado superior de excitación; es el consecuente retorno a su estado fundamental el que da como resultado la emisión de luz fluorescente, el cual puede ser detectado y medible. La luz emitida, resultante del fotón absorbido de energía hv (energía de fotón), tiene una longitud de onda específica. Es importante conocer esta longitud de onda de antemano para que cuando se esté realizando un experimento, el dispositivo de medición sepa a qué longitud de onda debe configurarse para detectar la producción de luz. Esta longitud de onda está determinada por la ecuación:
Con el numerador, donde h = constante de Planck, y c = la velocidad de la luz. Por lo general, aquí se usa un dispositivo de escaneo grande (CCD) para medir la intensidad y fotografiar la imagen de forma digital.[1]
Tintes vs proteínas fluorescentes[editar]
Los tintes fluorescentes, sin tiempo de maduración, ofrecen mayor fotoestabilidad y brillo en comparación con las proteínas fluorescentes. En términos de brillo, la luminosidad depende del coeficiente de extinción de los fluoróforos o, en su defecto, de la capacidad de éstos para absorber la luz; y de su eficiencia y/o eficacia "cuántica" para transformar la luz absorbida en luminiscencia de emisión fluorescente.
Los tintes en sí, no son muy fluorescentes, pero cuando son procesados y se unen a las proteínas, ven aumentada su eficacia, y por ende, son más fáciles de detectar (p. ej. NanoOrange, se unirá a la cobertura del recubrimiento y las regiones hidrófilas de una proteína mientras ésta sea inmune a los agentes reductores).
Con respecto a las proteínas, estas moléculas en sí mismas emitirán fluorescencia cuando absorban una longitud de onda de luz incidente específica. Un ejemplo de esto, la proteína fluorescente verde (GFP), emite fluorescencia verde cuando se expone a la luz en el rango azul a UV. Las proteínas fluorescentes son excelentes moléculas indicadoras que pueden ayudar a localizar proteínas, observar la unión de proteínas y cuantificar la expresión génica.[1]
Rango de imagen[editar]
Dado que algunas longitudes de onda de fluorescencia están más allá del alcance de la sensibilidad del ojo humano, se utilizan dispositivos de carga acoplada (CCD) para detectar con precisión la luz y generar imágenes de la emisión. Esto ocurre típicamente en el rango de los 300 - 800 nm. Una de las ventajas de la señalización fluorescente es que la intensidad de la luz emitida se comporta de forma bastante lineal con respecto a la cantidad de moléculas fluorescentes proporcionadas. Obviamente, esto depende de que la intensidad de la luz absorbida y la longitud de onda sean constantes. En términos de la imagen real en sí, generalmente tiene un formato de datos de 12 o 16 bits.[1]

Sistemas de imagen[editar]
Los componentes principales de los sistemas de imágenes por fluorescencia son:
- Fuente de excitación: un dispositivo que produce una fuente de longitud de onda amplia, como la luz ultravioleta, o una fuente de longitud de onda estrecha, como un láser.
- Óptica de visualización de luz: el mecanismo por el cual la luz ilumina la muestra. Esto se hace típicamente a través de la iluminación directa de la muestra.
- Óptica de variedad de luz: el método de recolección de la luz en sí. Esto típicamente constituye lentes, espejos y filtros.
- Filtración de la luz emitida: los filtros ópticos aseguran que la luz reflejada y dispersada no se incluya con la fluorescencia. Las tres clases de filtros de emisión son de paso largo, paso corto y paso de banda.
- Detección, amplificación y visualización: se utiliza un fotomultiplicador (PMT) o un dispositivo de carga acoplada (CCD) para detectar y cuantificar los fotones emitidos
Aplicaciones[editar]
- En PCR (electroforesis en gel de agarosa): SYBR Green es un tinte muy común que se une al ADN y se usa para visualizar bandas de ADN en un gel de agarosa. El tinte absorbe la luz azul y emite una fluorescencia verde para que lo capture un sistema de imágenes.
- Transferencia (occidental, septentrional y meridional): los fluorocromos pueden unirse a anticuerpos, ARN y ADN para emitir fluorescencia y cuantificar datos
- Secuenciación de ADN: la secuenciación de Sanger es una forma común de detección de ácido nucleico que puede usar ddNTP marcados con fluorescencia para obtener imágenes de picos de fluorescencia.
- Cirugía guiada por imágenes de fluorescencia: es un enfoque de imágenes médicas que etiqueta fluorescentemente una masa para ayudar en la navegación. Por ejemplo, el verde de indocianina se puede usar para detectar ganglios linfáticos en pacientes con cáncer.[4]
- Imágenes de fluorescencia con precisión de un nanómetro (FIONA): utiliza iluminación de reflexión interna total para reducir el ruido y aumentar el brillo de los fluoróforos
- Imágenes de calcio: técnica que utiliza moléculas fluorescentes llamadas indicadores de calcio que cambian de fluorescencia cuando se unen a iones Ca 2+. Esta es una parte clave para ver cuándo las células están activas en el sistema nervioso.[5]

Tipos de microscopía[editar]
Se puede emplear una variedad diferente de técnicas de microscopio para cambiar la visualización y el contraste de una imagen. Cada método tiene ventajas y desventajas, pero todos utilizan el mismo mecanismo de fluorescencia para observar un proceso biológico.
- Microscopía de fluorescencia de total reflexión interna: una técnica de microscopía que utiliza ondas evanescentes para observar selectivamente la fluorescencia de una sola molécula.[6]
- Microscopía de fluorescencia de hoja de luz: una técnica de microscopía de fluorescencia que ilumina una rebanada delgada de una muestra en un ángulo de examen perpendicular.[7]
- Microscopía de fluorescencia en secuencia de vida: una técnica de imágenes que registra los cambios en la fluorescencia a lo largo del tiempo
Ventajas[editar]
- No invasivo: la obtención de imágenes in vivo puede tener lugar sin tener que perforar la piel
- Sensible: las sondas están diseñadas para ser extremadamente sensibles a la detección de moléculas biológicas como ADN, ARN y proteínas.[1]
- Etiquetado múltiple: se pueden detectar múltiples fluorocromos dentro de las muestras, lo que permite una manera fácil de integrar estándares y un control.
- Estabilidad de las moléculas marcadas: las moléculas marcadas con fluorescencia utilizadas en la obtención de imágenes se pueden almacenar durante meses, mientras que otras moléculas, como las que están radiomarcadas, se descompondrán en unos pocos días.[7]
- Relativamente seguro de manejar: la mayoría de los fluoróforos se pueden manipular de manera segura y suficiente con guantes, mientras que, por ejemplo, los radioisótopos pueden requerir escudos de plomo u otra protección contra la radiación.[7]
- Eliminación simple: muchos fluoróforos requieren métodos de eliminación mínimos, mientras que los desechos radiactivos requieren una eliminación regulada y una manipulación a largo plazo. Esto también ayuda a reducir el costo necesario para utilizar estos productos.
Desventajas[editar]

- Fotoblanqueo: un problema frecuente con los fluoróforos donde el ciclo constante entre el estado fundamental y el estado excitado daña la molécula y reduce su intensidad.[7]
- Susceptibilidad ambiental: los factores ambientales como la temperatura, la concentración de iones y el pH pueden afectar la eficiencia y la emisión de fluorocromos
- Toxicidad: Los fluorocromos de Aome pueden ser tóxicos para las células, para los tejidos, in vivo o al producir mutaciones.[8]
- Poder de resolución limitado: los microscopios de fluorescencia tienen una capacidad limitada para distinguir objetos cercanos a nivel macroscópico. En comparación, los microscopios electrónicos, por ejemplo, tienen la capacidad de resolver en un rango mucho más pequeño.
- Rango de luminosidad inicial limitado: la intensidad de la fuente de luz de incidencia tiene un límite y más allá de este punto puede provocar la fotodestrucción de las moléculas.[1]
En general, esta forma de imagen es extremadamente útil en la investigación de vanguardia, con su capacidad para monitorear procesos biológicos. La progresión de las imágenes fluorescentes 2D a las 3D ha permitido a los científicos estudiar mejor la resolución y la precisión espacial. Además, con los esfuerzos concentrados hacia el análisis 4D,[9] los científicos ahora pueden monitorear una celda en tiempo real, lo que les permite monitorear procesos de acción rápida.
Direcciones futuras[editar]

El desarrollo de proteínas fluorescentes más eficaces es una tarea que muchos científicos han emprendido para mejorar las capacidades de las sondas de formación de imágenes. A menudo, las mutaciones en ciertos residuos pueden cambiar significativamente las propiedades fluorescentes de la proteína. Por ejemplo, al mutar el gen F64L en GFP de medusa, la proteína puede emitir fluorescencia de manera más eficiente a 37 °C, un atributo importante que se debe tener cuando se cultivan cultivos en un laboratorio.[10] Además de esto, la ingeniería genética puede producir una proteína que emite luz a una mejor longitud de onda o frecuencia.[10] Además, el medio ambiente en sí mismo puede jugar un papel crucial. La vida útil de la fluorescencia se puede estabilizar en un entorno polar (polaridad de un disolvente).
Los mecanismos que se han descrito bien pero que no se han incorporado necesariamente a las aplicaciones prácticas tienen un potencial prometedor para la obtención de imágenes por fluorescencia. La transferencia de energía por resonancia de fluorescencia (FRET) es un mecanismo extremadamente sensible que produce moléculas de señalización en el rango de 1-10 nm.[6]
Las mejoras en las técnicas que constituyen los procesos de fluorescencia también son cruciales para lograr diseños más eficientes. La espectroscopia de correlación de fluorescencia (FCS) es una técnica de análisis que observa la fluctuación de la intensidad de la fluorescencia; éste análisis es uno de los componente de muchas máquinas de imágenes de fluorescencia y sus aplicaciones podrían mejorar la sensibilidad y el rango en la resolución espacial.[6]
El desarrollo de sondas y técnicas analíticas más sensibles para la fluorescencia inducida por láser puede permitir más precisión en la obtener de los datos experimentales de hoy día.
Véase también[editar]
Referencias[editar]
- ↑ a b c d e f «Fluorescence Imaging Principles and Methods». Boston University. December 2012.
- ↑ Sirbu, Dumitru; Luli, Saimir; Leslie, Jack; Oakley, Fiona; Benniston, Andrew C. (17 de mayo de 2019). «Enhanced in vivo Optical Imaging of the Inflammatory Response to Acute Liver Injury in C57BL/6 Mice Using a Highly Bright Near-Infrared BODIPY Dye». ChemMedChem 14 (10): 995-999. ISSN 1860-7179. PMID 30920173. doi:10.1002/cmdc.201900181.
- ↑ «Fluorescence imaging—Latest research and news». Nature. Consultado el 18 de abril de 2019.
- ↑ Nagaya, Tadanobu; Nakamura, Yu A.; Choyke, Peter L.; Kobayashi, Hisataka (22 de diciembre de 2017). «Fluorescence-Guided Surgery». Frontiers in Oncology 7: 314. ISSN 2234-943X. PMC 5743791. PMID 29312886. doi:10.3389/fonc.2017.00314.
- ↑ «Fluorescence microscopy—pros and cons». DNA Learning Center. Consultado el 18 de abril de 2019.
- ↑ a b c Haustein, Elke; Schwille, Petra (September 2007). «Trends in fluorescence imaging and related techniques to unravel biological information». HFSP Journal 1 (3): 169-180. ISSN 1955-2068. PMC 2640989. PMID 19404444. doi:10.2976/1.2778852.
- ↑ a b c d Forero-Shelton, Manu (April 2019). «Peering into cells at high resolution just got easier». Nature Methods 16 (4): 293-294. ISSN 1548-7105. PMID 30886415. doi:10.1038/s41592-019-0373-3.
- ↑ Alford, Raphael; Simpson, Haley M.; Duberman, Josh; Hill, G. Craig; Ogawa, Mikako; Regino, Celeste; Kobayashi, Hisataka; Choyke, Peter L. (1 de noviembre de 2009). «Toxicity of Organic Fluorophores Used in Molecular Imaging: Literature Review». Molecular Imaging 8 (6): 341-354. ISSN 1536-0121. PMID 20003892. doi:10.2310/7290.2009.00031.
- ↑ «Llega el microscopio de super-resolución 4D, que ve en espacio y tiempo». Europa Press Ciencia. 28 de febrero de 2018. Consultado el 26 de mayo de 2023.
- ↑ a b Piston, David W.; Davidson, Michael W.; Cranfill, Paula J.; Gilbert, Sarah G.; Kremers, Gert-Jan (15 de enero de 2011). «Fluorescent proteins at a glance». J Cell Sci 124 (2): 157-160. ISSN 0021-9533. PMC 3037093. PMID 21187342. doi:10.1242/jcs.072744.
Enlaces externos[editar]
- Yu, Jyao; Harankhedkar, Shefali; Nabatilan, Arielle; Fahrni, Christopher (2021). «Chapter 4: Imaging Trace Metals in Biological Systems». En Kroneck, Peter M.H.; Sosa Torres, Martha, eds. Metals, Microbes and Minerals: The Biogeochemical Side of Life. Volume 21 in the series Metal Ions in Life Sciences. Berlin: Walter de Gruyter. pp. 81-134. ISBN 9783110589771. doi:10.1515/9783110589771-010(requiere suscripción).

