Diferencia entre revisiones de «Siloxano»
m Pequeños detalles de las fórmulas Etiqueta: editor de código 2017 |
m Correcciones ortográficas con Replacer (herramienta en línea de revisión de errores) |
||
| Línea 9: | Línea 9: | ||
== Nomenclatura == |
== Nomenclatura == |
||
[[File:Decamethylcyclopentasiloxane.svg|thumb|[[Decametilciclopentasiloxan0]], o D<sub>5</sub>, a siloxan0cíclico.]] |
[[File:Decamethylcyclopentasiloxane.svg|thumb|[[Decametilciclopentasiloxan0]], o D<sub>5</sub>, a siloxan0cíclico.]] |
||
La palabra '' siloxano '' se deriva de las |
La palabra '' siloxano '' se deriva de las raíces '''sil'''icio, '''''ox'''''ígeno y alc'''ano'''. En algunos casos, los siloxano se componen de varios tipos diferentes de grupos siloxano; estos están etiquetados de acuerdo con el número de enlaces Si-O. |
||
M-units: (CH<sub>3</sub>)<sub>3</sub>SiO<sub>0.5</sub>, |
M-units: (CH<sub>3</sub>)<sub>3</sub>SiO<sub>0.5</sub>, |
||
D-units: (CH<sub>3</sub>)<sub>2</sub>SiO, |
D-units: (CH<sub>3</sub>)<sub>2</sub>SiO, |
||
Revisión del 11:30 19 may 2020
Un siloxano es un grupo funcional en química de organosilicio con el enlace Si – O – Si.

Los siloxanos originales incluyen los hidruros oligoméricos y poliméricos con las fórmulas H (OSiH2)nOH y (OSiH2)n. [1] Los siloxanos también incluyen compuestos ramificados, cuya característica definitoria es que cada par de centros de silicio está separado por un átomo de oxígeno. El grupo funcional siloxano forma la columna vertebral de las siliconas, cuyo principal ejemplo es el polidimetilsiloxano. [2] El grupo funcional R3SiO- (donde las tres R pueden ser diferentes) se llama siloxi. Los siloxanos son artificiales y tienen muchas aplicaciones comerciales e industriales debido a las características hidrofóbicas, baja conductividad térmica y alta flexibilidad de sus derivados. [3]
Estructura
Los siloxanos generalmente adoptan la esperada estructura tetraédrica con los núcleos unidos por enlaces ("tipo sp3"). La longitud del enlace Si – O es 1.64 Å (vs distancia Si – C de 1.92 Å) y el ángulo Si – O – Si es bastante abierto a 142.5 °. [4] Por el contrario, la distancia C – O en un dialquil éter típico es mucho más corta a 1.414 (2) Å con un ángulo C – O – C más agudo de 111 °. [5] Se puede apreciar que los siloxanos tendrían bajas barreras para la rotación alrededor de los enlaces Si-O como consecuencia de un bajo impedimento estérico. Esta consideración geométrica es la base de las propiedades útiles de algunos materiales que contienen siloxano, como sus bajas temperaturas de transición vítrea.
Nomenclatura
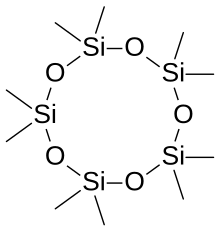
La palabra siloxano se deriva de las raíces silicio, oxígeno y alcano. En algunos casos, los siloxano se componen de varios tipos diferentes de grupos siloxano; estos están etiquetados de acuerdo con el número de enlaces Si-O. M-units: (CH3)3SiO0.5, D-units: (CH3)2SiO, T-units: (CH3)SiO1.5
| Siloxanos cíclicos (ciclometiconas) | CAS | Siloxanos lineales | CAS |
|---|---|---|---|
| L2, MM: hexametildisiloxano | 107-46-0 | ||
| D3: hexametillciclotrisiloxano | 541-05-9 | L3, MDM: octametiltrisiloxano | 107-51-7 |
| D4: octametilciclotetrasiloxano | 556-67-2 | L4, MD2M: decametilltetrasiloxano | 141-62-8 |
| D5: decametillciclopentasiloxano | 541-02-6 | L5, MD3M: dodecametilpentasiloxano | 141-63-9 |
| D6: dodecametilciclohexasiloxano | 540-97-6 | L6, MD4M: tetradecametilhexasiloxano | 107-52-8 |
Síntesis de siloxanos

La principal ruta al grupo funcional siloxano es por hidrólisis de los cloruro de silicio:
- 2 R3Si–Cl + H2O → R3Si–O–SiR3 + 2 HCl
La reacción procede a través de la formación inicial de silanoles (R3Si – OH):silanols (R3Si–OH):
- R3Si–Cl + H2O → R3Si–OH + HCl
El enlace de siloxano se puede formar a través de una vía silanol + silanol o una vía silanol + clorosilano:
- 2 R3Si–OH → R3Si–O–SiR3 + H2O
- R3Si–OH + R3Si–Cl → R3Si–O–SiR3 + HCl
La hidrólisis de un cloruro de sililo puede proporcionar productos lineales o cíclicos. Los productos lineales se terminan con grupos silanol:
- n R2Si(OH)2 → H(R2SiO)nOH + (n−1) H2O
Los productos cíclicos no tienen términos de silanol:
- n R2Si(OH)2 → (R2SiO)n + n H2O
Los productos lineales, polidimetillsiloxano (PDMS), son de gran valor comercial. la producción requiere la obtención de dicloeuro de dimetillsilicon.
A partir de trisilanoles, son posibles las jaulas, con estructura cúbica (RSi)nO3n/2(n = 8) y prismático hexagonal, estructuras(RSi)8O12(n = 12) . Las jaulas cúbicas son grupos de tipo cubano, con núcleos de silicio situados en los vértices de un cubo formado por núcleos de oxígeno que componen las doce aristas. [7](RSi)nO3n/2 con cúbico (n = 8) y prismático hexagonal (n = 12). (RSi)8O12 structures. Las jaulas cúbicas son clusters del tipo del cubano, con centros de silicio en las esquinas de los centros de oxígeno de un cubo que abarca cada uno de los doce bordes. [2]
Reacciones
La oxidación de los compuestos organosilíceos, incluidos los siloxanos, proporciona dióxido de silicio. Esta conversión se ilustra mediante la combustión de hexametilciclotrisiloxano:
- ((CH3)2SiO)3 + 12 O2 → 3 SiO2 + 6 CO2 + 9 H2O
Las bases fuerte degrada el grupo siloxano, a menudo dando sales de siloxido:siloxide salts:
- ((CH3)3Si)2O + 2 NaOH → 2 (CH3)3SiONa + H2O
Esta reacción procede por la producción de silanoles. Reacciones similares se utilizan industrialmente para convertir siloxanos cíclicos en polímeros lineales. [2][3]
Usos
Los polisiloxanos, por combustión en una atmósfera inerte, generalmente se someten a pirólisis para formar oxicarburo de silicio o carburo de silicio (SiC). Al explotar esta reacción, los polisiloxanos se han utilizado como polímeros precerámicos en diversos procesos, incluida la fabricación aditiva. El uso de un precursor de polisiloxano en cerámicas derivadas de polímeros permite la formación de cuerpos cerámicos con formas complejas, aunque es necesario tener en cuenta la contracción significativa en la pirólisis.
Siloxanos en el biogás
Gran parte de los siloxanos utilizados en cosmética, alimentación, aditivos de plásticos, etc. son eliminados a través de las aguas residuales o residuos sólidos urbanos. Al producir biogás por fermentación anaerobia de lodos de EDAR o Residuos Sólidos Urbanos, los siloxanos de bajo punto de ebullición son destilados y se incorporan en la corriente de biogás .
Posteriormente, al enfriar la corriente de gas pueden solidificarse provocando bloqueos en conducciones, válvulas y equipo. En la posterior combustión, los siloxanos se transforman en dióxido de silicio, sustancia sólida de alto punto de fusión que se deposita en mecheros, intercambiadores y pistones de motores causando obstrucciones, pérdida de capacidad de intercambio y deterioro por abrasión.
Referencias
- ↑ Silicon: Organosilicon Chemistry. Encyclopedia of Inorganic Chemistry Online, 2nd ed.; Wiley: New Jersey, 2005. doi 10.1002/0470862106.ia220
- ↑ S. D. Kinrade, J. C. H. Donovan, A. S. Schach y C. T. G. Knight (2002), "Two substituted cubic octameric silicate cages in aqueous solution.". J. Chem. Soc., Dalton Trans., 1250 - 1252. doi 10.1039/b107758a
- ↑ Röshe, L.; John, P.; Reitmeier, R. "Organic Silicon Compounds" Ullmann’s Encyclopedia of Industrial Chemistry. John Wiley and Sons: San Francisco, 2003. doi 10.1002/14356007.a24_021.
