Aurotiomalato
| Aurotiomalato | ||
|---|---|---|
 | ||
| Nombre (IUPAC) sistemático | ||
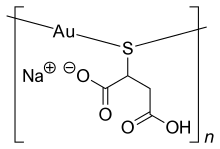
| sodio, oro (1 +), hidron, 2-sulfidobutanodioato | ||
| Identificadores | ||
| Número CAS | 12244-57-4 | |
| Código ATC | M01CB01 | |
| Código ATCvet | No adjudicado | |
| PubChem | 11954225 | |
| DrugBank | DB09276 | |
| Datos químicos | ||
| Fórmula | C4H4O4SNaAu | |
| Peso mol. | 368.088 g/mol | |
| Datos clínicos | ||
| Nombre comercial | Myochrysine® | |
| Uso en lactancia | Restricción total del uso del fármaco. (en todos los países) | |
| Cat. embarazo | No hay estudios en humanos. El fármaco solo debe utilizarse cuando los beneficios potenciales justifican los posibles riesgos para el feto. Queda a criterio del médico tratante. (EUA) | |
| Estado legal | Grupo IV (Medicamentos expedidos mediante receta médica, autorizados para su venta exclusivamente en farmacias.) (MEX) | |
| Vías de adm. | Vía intramuscular | |
El Aurotiomalato, tiomalato sódico de oro o aurotiomalato sódico, es un fármaco perteneciente a los compuestos de oro empleado en la artritis reumatoide que se caracterizó por primera vez en la década de 1920.[1] Al igual que su congénere, la aurotioglucosa, es de administración intramuscular.[2]
Descripción[editar]
El fármaco está disponible como polvo que contiene especies poliméricas donde los iones de oro se coordinan de manera lineal con los ligandos de azufre.[1] La estructura polimérica presenta una geometría lineal -S-Au-S-; y la evidencia espectroscópica señala que la cadena oligomérica adopta una conformación helicoidal.[3]
El aurotiomalato inhibe fuertemente las catepsinas K y S (que desempeñan papeles preponderantes en los componentes inflamatorios y erosivos de la artritis reumatoide); un análisis de rayos X del complejo aurotiomalato/catepsina K reveló que el inhibidor está unido al residuo cisteína del sitio activo de la enzima proteasa.[4]
Uso indicado[editar]
El aurotiomalato se prescribe para pacientes con artritis reumatoide progresiva que son refractarios a otros fármacos como los AINEs.[2]
Uso en embarazo y lactancia[editar]
No se recomienda.
Efectos secundarios[editar]
Los efectos vasomotores y no motores se limitan casi por completo al uso de aurotiomalato. El médico especialista podrá sustituir el fármaco por aurotioglucosa o auranofín lo que generalmente evitará nuevos episodios. La reacción vasomotora (o nitritoide) se caracteriza por sensaciones de enrojecimiento, eritema generalizado, vértigo, debilidad y ocasionalmente hipotensión y síncope, que aparecen minutos después de la inyección. La reacción es generalmente transitoria y sin consecuencias, pero se ha descrito un infarto agudo de miocardio.[5]
Usos en investigación[editar]
El aurotiomalato se ha empleado en pénfigo y artritis psoriásica.[5]
El aurotiomalato se está reconsiderando como fármaco candidato para el tratamiento del cáncer y para otras indicaciones terapéuticas dentro de un programa más general de reposicionamiento de medicamentos. Se reportó que el aurotiomalato manifiesta interesantes propiedades anticancerígenas; en consecuencia, fue ampliamente probado como agente anticancerígeno en algunos modelos preclínicos (in vivo e in vitro de cáncer de pulmón de células no pequeñas), que es el tipo de cáncer pulmonar más común.[6] El mecanismo de las acciones anticancerígenas del aurotiomalato no se ha dilucidado completamente, aunque ahora existe considerable evidencia de que el fármaco produce algunos de sus efectos al dirigirse al dominio PB1 de la proteína quinasa C.
Además, grupos de investigación independientes han documentado que otras sales de oro, como el auranofín, y la aurotioglucosa, también pueden ser útiles en el tratamiento de la enfermedad por Schistosoma mansoni ya que los tres actúan como potentes inhibidores de la enzima parásita tiorredoxina glutatión reductasa.[7][8]
Véase también[editar]
Referencias[editar]
- ↑ a b Darabi, Farivash; Marzo, Tiziano; Massai, Lara; Scaletti, Federica; Michelucci, Elena; Messori, Luigi (Agosto de 2015). «Reactions of model proteins with aurothiomalate, a clinically established gold(I) drug: The comparison with auranofin». Journal of Inorganic Biochemistry 149: 102-107. doi:10.1016/j.jinorgbio.2015.03.013. Consultado el 18 de marzo de 2018.
- ↑ a b Goodman Gilman, Alfred; Goodman, Louis S.; [et al] (1986). «[29] Farmacoterapia de la inflamación». Goodman y Gilman: las bases farmacológicas de la terapéutica (7a. ed. edición). Buenos Aires: Médica Panamericana. pp. 669-670. ISBN 9500608472.
- ↑ Bau, Robert (Septiembre de 1998). «Crystal Structure of the Antiarthritic Drug Gold Thiomalate (Myochrysine): A Double-Helical Geometry in the Solid State». Journal of the American Chemical Society 120 (36): 9380-9381. doi:10.1021/ja9819763. Consultado el 18 de marzo de 2018.
- ↑ Weidauer, Enrico; Yasuda, Yoshiyuki; Biswal, Bichitra K.; Cherny, Maia; James, Michael N.G.; Brömme, Dieter (1 de enero de 2007). «Effects of disease-modifying anti-rheumatic drugs (DMARDs) on the activities of rheumatoid arthritis-associated cathepsins K and S». Biological Chemistry 388 (3). doi:10.1515/BC.2007.037. Consultado el 18 de marzo de 2018.
- ↑ a b Thomas, Isabelle (Abril de 1987). «Gold therapy and its indications in dermatology» [Crisoterapia y sus indicaciones en dermatología)]. Journal of the American Academy of Dermatology 16 (4): 845-854. doi:10.1016/S0190-9622(87)70111-X. Consultado el 18 de marzo de 2018.
- ↑ «Cáncer pulmonar de células no pequeñas». Medline Plus. U.S. National Library of Medicine. Consultado el 18 de marzo de 2018.
- ↑ Kuntz, Angela N; Davioud-Charvet, Elisabeth; Sayed, Ahmed A; Califf, Lindsay L; Dessolin, Jean; Arnér, Elias S. J; Williams, David L; Loukas, Alex (Junio de 2007). «Thioredoxin Glutathione Reductase from Schistosoma mansoni: An Essential Parasite Enzyme and a Key Drug Target». PLoS Medicine 4 (6): e206. doi:10.1371/journal.pmed.0040206.
- ↑
