Conrotatorio y disrotatorio
Una reacción electrocíclica puede ser clasificada ya sea como conrotatoria o como disrotatoria según la forma en que se produzca la rotación de cada extremo de la molécula. En el modo conrotatorio, ambos orbitales atómicos de los grupos terminales giran en la misma dirección (ya sea que ambos giran en sentido horario o antihorario). En el modo disrotatorio, los orbitales atómicos de los grupos terminales giran en direcciones opuestas (uno de los orbitales atómicos gira en sentido horario, mientras que el otro lo hace en el sentido antihorario). La geometría cis/trans del producto final se encuentra directamente decidida por las diferencias entre la conrotación o la disrotación.
Mecansimo
[editar]Se puede determinar si una reacción en particular es conrotatoria o disrotatoria examinando los orbitales moleculares de cada molécula y siguiendo una serie de reglas. Solo se requieren dos fragmentos de información para determinar una conrotación o una disrotación: cuantos electrones se encuentran en el sistema pi y si la reacción se encuentra inducida por calor o por luz. Este conjunto de reglas también puede derivarse del análisis de orbitales moleculares para la predicción de reacciones estereoquímicas o electrocíclicas.
| Sistema | Térmica | Fotoquímica |
|---|---|---|
| "4n" electrones | Conrotatoria | Disrotatoria |
| "4n + 2" electrones | Disrotatoria | Conrotatoria |
Ejemplo de una reacción fotoquímica
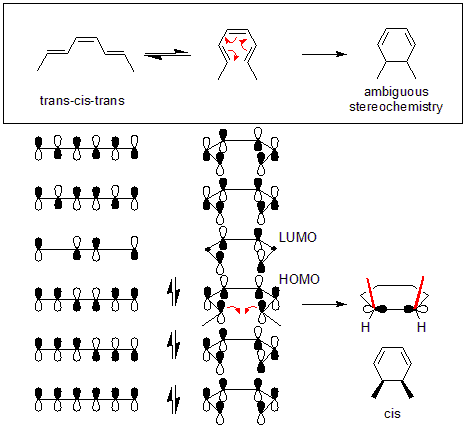
[editar]El análisis de una reacción electrocíclica fotoquímica involucra el análisis HOMO, LUMO y diagramas de correlación.
Un electrón es promovido a LUMO cambiando al orbital molecular fronterizo involucrado en la reacción.
Ejemplo de una reacción térmica
[editar]Supóngase que el trans-cis-trans-2,4,6-octatrieno se convierte en dimetilciclohexadieno bajo condiciones térmicas. Ya que el octatrieno sustrato es una molécula "4n + 2", las reglas de Woodward-Hoffmann predicen que la reacción ocurre por un mecanismo disrotatorio.
Ya que las reacciones electrocíclicas térmicas ocurren en el HOMO, es necesario primeramente dibujar un diagrama de orbitales moleculares apropiado. A continuación, el nuevo enlace carbono-carbono se forma por la adquisición de dos de los orbitales p rotándolos 90 grados (véase el diagrama). Como el nuevo enlace requiere de una superposición constructiva, los orbitales tienen que rotar de determinada manera. Al llevar a cabo una disrotación se produce la superposición de dos lóbulos oscuros, formando un nuevo enlace. Por lo tanto, la reacción con el octatrieno ocurre a través de un mecanismo disrotatorio.
En contraste, si se ha llevado a cabo una conrotación, entonces un lóbulo oscuro se superpone con uno claro. Esto provoca interferencia destructiva, por lo que no es posible que se forme un nuevo enlaces carbono-carbono.
Adicionalmente, también se puede determinar la geometría cis/trans del producto. Cuando los orbitales p rotan hacia adentro, los dos grupos metilo rotan hacia arriba. Ya que los dos grupos metilo apuntan "arriba", entonces el producto es cis-dimetilciclohexadieno.
Referencias
[editar]- Carey, Francis A.; Sundberg, Richard J.; (1984). Advanced Organic Chemistry Part A Structure and Mechanisms (2nd ed.). New York N.Y.: Plenum Press. ISBN 0-306-41198-9.
- March Jerry; (1985). Advanced Organic Chemistry reactions, mechanisms and structure (3rd ed.). New York: John Wiley & Sons, inc. ISBN 0-471-85472-7
