Asistencia anquimérica
La Asistencia Anquimérica, denominada también como Participación de grupo vecino (NGP) se define en química orgánica por la IUPAC como la interacción de un centro de reacción con un par solitario de electrones en un átomo o los electrones en un enlace sigma o pi en donde se enlaza reversiblemente sin conjugación en resonancia con el centro de reacción. Cuándo opera la NGP es normal que el índice de reacción aumente. Es también posible que ocurra cuando se detecta una estereoquímica anormal (o inesperada) cuándo se compara con una reacción normal. Mientras que es posible para varios grupos vecinos influir en muchas reacciones en química orgánica (p. ej. la reacción de un dieno como el 1,3-ciclohexadieno con anhídrido maleico normalmente forma el isómero endo debido a un efecto secundario (el solapamiento de los orbitales π del grupo carbonilo con el estado de transición en la reacción de Diels-Alder ), esta página está limitada al efecto del grupo vecino visto con carbocationes y reacciones SN2.
NGP por pares libres de un heteroátomo[editar]
Un ejemplo clásico de NGP es la reacción de una mostaza de azufre o de nitrógeno con un nucleófilo, el índice de reacción es mucho más alto para la mostaza de azufre con un nucleófilo que para un cloruro de alquilo primario sin un heteroátomo.

...
NGP Por un alqueno[editar]
Los orbitales π de un alqueno pueden estabilizar un estado de transición para ayudar a delocalizar la carga positiva del carbocatión. Para el caso de un tosilato insaturado, este reaccionará más deprisa (1011 veces más rápido que para la solvólisis acuosa) con un nucleófilo que un tosilato saturado.
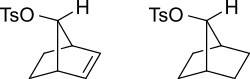
El intermediario carbocatiónico será estabilizado por resonancia en donde la carga positiva se encuentra extendida sobre varios átomos, en el esquema bajo este está mostrado.
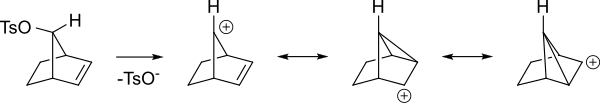
Aquí es una vista diferente de los mismos intermediarios.

Incluso si el alqueno se encuentra en un aposición más remota del centro de reacción, el alqueno todavía puede actuar de este modo. Para caso en el siguiente benzenesulfonato de alquilo, el alqueno es capaz de deslocalizas al carbocation.
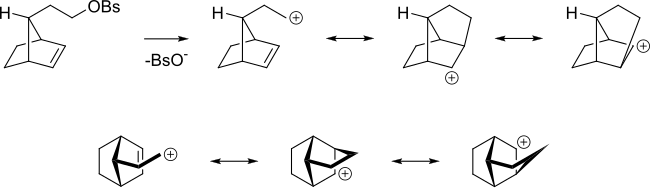
También el aumento en el índice de la reacción SN2 de bromuro de alilo con un nucleófilo, comparada con la reacción del bromuro de n-propilo debido al translape de los orbitales π en el estado de transición. En el sistema alílico, se translapan los orbitales del alqueno con los orbitales de un estado de transición SN2.
NGP por un ciclopropano, ciclobutano o un homoalilo[editar]
Si el cloruro de ciclopropilmetilo reacciona con etanol y agua, se forma una mezcla de 48% de alcohol ciclopropilmetílico, 47% de ciclobutanol y 5% de alcohol homoalílico (but-3-enol). Esto es porque el intermedio carbocatiónico se delocaliza a muchos carbonos diferentes a través de un anillo que se abre reversiblemente.

NGP Por un anillo aromático[editar]
En el caso de un halogenuro de bencilo, la reactividad es más alta porque el estado de transición SN2 presenta un solapamiento similar a aquel formado en el sistema alílico.

Un anillo aromático puede asistir en la formación de un intermediario carbocatiónico llamado ion fenonio por deslocalización de la carga positiva.
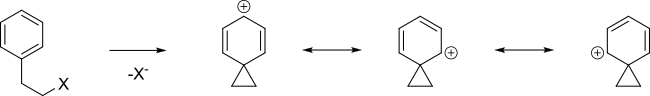
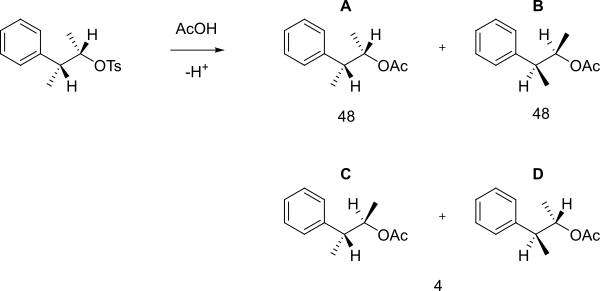
Cuando el siguiente tosilato reacciona con ácido acético en condiciones de solvólisis, entonces se obtiene una mezcla 48:48:4 de A, B (son enantiómeros) y C + D, en vez de una SN2 sencilla en la que se forma B.
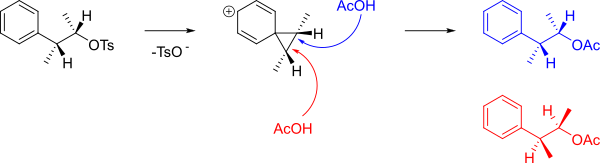
El mecanismo qué que explica la formación de A y B se muestra a continuación.
NGP Por enlaces C-C o C-H alifáticos[editar]
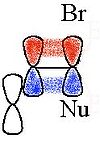
Los enlaces alifáticos C-C o C-H pueden dirigir la deslocalización de la carga si esos enlaces se encuentran cercanos y antiperiplanares al grupo saliente. Los intermediarios corrrespondientes son referidos como iones no clásicos, siendo el sistema 2-norbornilo el caso más conocido.
Enlaces externos[editar]
Referencias[editar]
- ^ Advanced organic chemistry, page 314, Jerry March (4th Ed), Wiley-Interscience.
- ^ Studies in Stereochemistry. I. The Stereospecific Wagner-Meerwein Rearrangement of the Isomers of 3-Phenyl-2-butanol Donald J. Cram J. Am. Chem. Soc.; 1949; 71(12); 3863-3870. Abstract
- ^ Studies in Stereochemistry. V. Phenonium Sulfonate Ion-pairs as Intermediates in the Intramolecular Rearrangements and Solvolysis Reactions that Occur in the 3-Phenyl-2-butanol System Donald J. Cram J. Am. Chem. Soc.; 1952; 74(9); 2129-2137 Abstract.
