Yoduro de metilo
| yoduro de metilo | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Yodometano | ||
| General | ||
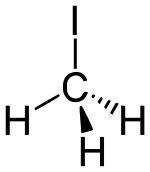
| Fórmula estructural |
 | |
| Fórmula molecular | CH3I | |
| Identificadores | ||
| Número CAS | 74-88-4[1] | |
| Número RTECS | PA9450000 | |
| ChEBI | 39282 | |
| ChEMBL | CHEMBL115849 | |
| ChemSpider | 6088 | |
| PubChem | 6328 | |
| UNII | DAT010ZJSR | |
| KEGG | C18448 | |
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 2280 kg/m³; 2,28 g/cm³ | |
| Masa molar | 14 193 899 g/mol | |
| Punto de fusión | −66 °C (207 K) | |
| Punto de ebullición | 42 °C (315 K) | |
| Índice de refracción (nD) | 1,530–1,531 | |
| Propiedades químicas | ||
| Solubilidad en agua | 14 g/L | |
| Peligrosidad | ||
| SGA |
  | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El yoduro de metilo, también llamado yodometano, y comúnmente abreviado "MeI", es el compuesto químico de fórmula molecular CH3I de la familia de los haloalcanos. Es un líquido incoloro, denso y volátil. En términos de estructura química, se relaciona con el metano por sustitución de un átomo de hidrógeno por un átomo de yodo. Se ha demostrado en estudios con animales que es carcinógeno.[2] El yodometano reacciona con los metales alcalinos y alcalinotérreos, y se utiliza en síntesis orgánica como una fuente de grupos metilo para la metilación (introducción de un grupo metilo).
Se emite de manera natural en las plantaciones de arroz (en pequeñas cantidades).[3] También se produce en grandes cantidades estimándose cantidades superiores a las 214.000 toneladas anuales por las algas en los ecosistemas acuáticos y, en menor cantidad en la tierra, debido a hongos terrestres y bacterias .
El yoduro de metilo ha sido aprobado para su uso como plaguicida por la Agencia de Protección Ambiental de los Estados Unidos (EPA) en 2007 se utiliza como biocida antes de la siembra para el control de insectos, nematodos parásitos de las plantas, agentes patógenos transmitidos por el suelo, y semillas de malas hierbas.[4] El compuesto se ha usado para el tratamiento del suelo antes de la siembra de fresas, pimientos, tomates, vides, plantas ornamentales y césped, frutas con hueso, frutos secos, y árboles de coníferas; hasta que el fabricante retiró el fumigante citando su falta de viabilidad comercial.[5]
Preparación y manipulación[editar]
El yoduro de metilo se forma a través de la reacción exotérmica que se produce cuando se añade yodo a una mezcla de metanol con fósforo rojo[6] El reactivo de yodación es triyoduro de fósforo que se forma in situ:
Alternativamente, se prepara a partir de la reacción de sulfato de dimetilo con yoduro de potasio en presencia de carbonato de calcio:[6]
El yoduro de metilo se puede preparar también por la reacción de metanol con yoduro de potasio, catalizada por ácido:
La reacción se lleva a cabo a baja temperatura y el agua generada en la reacción es atrapado por exceso de ácido sulfúrico por lo que la reacción no es reversible. El yoduro de metilo generado puede ser destilado de la mezcla de reacción.
Almacenamiento y purificación[editar]
Al igual que muchos compuestos halogenados, el yoduro de metilo normalmente se almacena en botellas oscuras para inhibir la degradación fotoquímica causada por la luz (que descompone el compuesto en yodo y metano), dando un tinte violáceo debido a la formación del citado halógeno. Comercialmente puede ser estabilizado por alambre de cobre o plata. Se puede purificar por un lavado con Na2S2O3 para eliminar el yodo formado seguido por destilación.
Reactividad[editar]
El yoduro de metilo es un excelente sustrato para reacciones de sustitución nucleófila SN2. Es estéricamente abierto (no tiene impedimento estérico) para el ataque de nucleófilos, y el yoduro es un buen grupo saliente. Se utiliza para la alquilación de átomos de carbono, oxígeno, azufre, nitrógeno, y fósforo. Por desgracia, tiene un alto peso equivalente: un mol de yoduro de metilo pesa casi tres veces más que un mol de cloruro de metilo. Por otro lado, el cloruro de metilo y el bromuro de metilo son gaseosos, por lo tanto más difícil de manejar, y también son agentes alquilantes más débiles.
Los yoduros son generalmente más caros en relación con los cloruros y bromuros más comunes, aunque el yoduro de metilo es razonablemente asequible. A escala industrial, se prefiere el sulfato de dimetilo (más tóxico), ya que es barato y tiene un punto de ebullición más alto. El yoduro (grupo saliente) en el yoduro de metilo puede causar reacciones secundarias, ya que es un potente nucleófilo. Por último, al ser altamente reactivos, el yoduro de metilo es más peligroso para los trabajadores de laboratorio que los cloruros y bromuros relacionados.
Por ejemplo, se puede utilizar para proteger ciertos grupos funcionales, como ocurre con la metilación de los ácidos carboxílicos o fenoles:[7]

En estos ejemplos, la base (K2CO3 o Li2CO3) elimina el protón ácido para formar el anión carboxilato o fenóxido, que sirve como nucleófilo en la reacción de sustitución SN2.
El amoníaco y las aminas reaccionan con yodometano para formar yoduros de amonio. En estos iones de amonio cuaternario que se pueden producir, la amina se libera usando una base:

Efectos fisiológicos[editar]
Los diferentes reactivos de metilación(como el sulfato de dimetilo, etc) son carcinógenos y muy tóxicos. El efecto carcinógeno está causalmente relacionado con el efecto de esa metilación característica de estos compuestos. El yoduro de metilo es un muy buen electrófilo y por lo tanto tiende a sufrir reacciones de sustitución nucleófila con nucleófilos endógenos. Esto conduce a la metilación del ADN durante la división celular, que ya no puede entonces ser leído correctamente por la ADN polimerasa.[8]
Bibliografía[editar]
- ↑ Número CAS
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online – Version 3.11. Georg Thieme Verlag KG, Stuttgart 2011.
- ↑ K. R. Redeker, N.-Y. Wang, J. C. Low, A. McMillan, S. C. Tyler, and R. J. Cicerone (2000). «Emissions of Methyl Halides and Methane from Rice Paddies». Science 290 (5493): 966-969. PMID 11062125. doi:10.1126/science.290.5493.966.
- ↑ «Methyl iodide gains state OK for use on crops». San Francisco Chronicle. 2 de diciembre de 2010.
- ↑ «Maker of methyl iodide scraps controversial pesticide». San Jose Mercury News. 20 de marzo de 2012.
- ↑ a b S. King, Harold (1943). «Methyl Iodide». Organic Syntheses 2: 399. Archivado desde el original el 5 de junio de 2011. Consultado el 20 de julio de 2013.
- ↑ Avila-Zárraga, J. G., Martínez, R (2001). «Efficient methylation of carboxylic acids with potassium hydroxide/methyl sulfoxide and iodomethane». Synthetic Communications: An International Journal for Rapid Communication of Synthetic Organic Chemistry 31 (14). doi:10.1081/SCC-100104469.
- ↑ Carsten Schmuck, Bernd Engels, Tanja Schirmeister, Reinhold Fink: Chemie für Mediziner, Pearson Studium, S. 457, ISBN 978-3-8273-7286-4.



