Usuario:Gonpival/Taller
La electrólisis es el proceso que separa los elementos de un compuesto por medio de la electricidad. En ella ocurre la liberación de electrones por los aniones en el ánodo (una oxidación) y la captura de electrones por los cationes en el cátodo (una reducción). Este proceso se lleva a cabo en una clase importante de celdas electroquímicas que se conocen
como celdas electrolíticas, donde se usa una corriente eléctrica para activar una reacción no espontánea. La electrólisis se basa en los mismos principios en que se fundamentan
los procesos que se realizan en las celdas galvánicas.
Una celda galvánica convierte energía química en energía eléctrica, cuando una reacción con valor positivo de E (valor negativo de G) procede hacia el equilibrio; una celda electrolítica convierte energía eléctrica en energía química cuando una corriente eléctrica impulsa una reacción con valor negativo de E (y valor positivo de G) en dirección que se
aleja del equilibrio. Así, los procesos que suceden en celdas galvánicas y electrolíticas son inversos entre sí.
El proceso de usar una corriente eléctrica para producir un cambio se conoce como electrólisis.
Relación entre potenciales de celda E y cambios de energía libre G[editar]
| Tipo de Reacción | E | G | Tipo de celda |
|---|---|---|---|
| Espontánea | Galvánica | ||
| No espontánea | Electrolítica | ||
| Equilibrio | 0 | 0 | Batería muerta |
Electrólisis del cloruro de sodio fundido[editar]
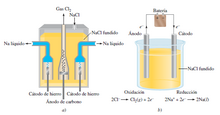
En su fase fundida, el cloruro de sodio (un compuesto iónico) se puede electrolizar para formar sodio metálico y cloro. En el NaCl fundido, los cationes y los aniones son los iones Na+ y Cl-, respectivamente. La figura que se muestra debajo, es un diagrama simplificado que muestra las reacciones que tienen lugar en los electrodos. La celda electrolítica contiene un par de electrodos conectados a una batería. Ésta funciona como una “bomba de electrones ” que los lleva hacia el cátodo, donde se efectúa la reducción y los retira del ánodo, donde se realiza la oxidación. Las reacciones en los electrodos son:

Este proceso es la fuente principal de sodio metálico puro y de gas cloro.
Los cálculos teóricos indican que el valor de E° para el proceso global es de aproximadamente 24 V, lo que significa que este proceso es no espontáneo. Por consiguiente, la batería debe suministrar un mínimo de 4 V para que la reacción se lleve a cabo. En la práctica, sin embargo, se necesita un voltaje mayor debido a la ineficiencia del proceso electrolítico y al sobrevoltaje.[1]
a) Dispositivo
práctico denominado celda de
Downs para la electrólisis del NaCl
fundido (p.f. 5 801ºC). El sodio
metálico formado en los cátodos
se encuentra en el estado líquido.
Dado que el sodio metálico líquido
es más ligero que el NaCl fundido,
el sodio flota hacia la superficie,
como se muestra, y se recolecta.
El gas cloro se forma en el ánodo
y se recolecta en la parte superior.
b) Diagrama simplificado que
muestra las reacciones en los
electrodos durante la electrólisis del
NaCl fundido. La batería es
necesaria para conducir las
reacciones no espontáneas.
Electrólisis de cloruro de sodio acuoso[editar]
Entre los tres ejemplos que mencionamos este es el más complicado ya que una disolución acuosa de cloruro de sodio contiene varias especies que pueden oxidarse y reducirse. Cuando se electroliza una disolución acuosa de sal, las reacciones de electrodo pueden ser distintas a las de la electrólisis de la sal fundida, porque puede intervenir el agua. En la electrólisis del cloruro de sodio acuoso, por ejemplo, la media reacción en el cátodo podría ser la reducción de Na+ a sodio metálico, como en el caso del cloruro de sodio fundido, o bien, la reducción de agua para formar hidrógeno gaseoso:
2 H2O(l) + 2 e�¡H2(g) + 2 OH�(ac) E° = -0.83 V
En vista de que el potencial estándar es mucho menos negativo para la reducción de agua que para la reducción de Na+, se reduce el agua y en el cátodo se producen burbujas de hidrógeno gaseoso.
La media reacción anódica podría ser la oxidación de Cl� a Cl2 gaseoso, como en el caso del cloruro de sodio fundido, o la oxidación de agua para formar oxígeno gaseoso:
2 H2O(l)¡O2(g) + 4 H�(ac) + 4 e� E° = -1.23 V
2 Cl�(ac)¡Cl2(g) + 2 e� E° = -1.36 V
De acuerdo con los valores de E°, cabe esperar una ligera preferencia para la oxidación del agua en una disolución con concentraciones iónicas 1 M. Para una disolución neutra ([H�]� 10�7 M), la preferencia hacia la oxidación del agua será todavía mayor, ya que su
potencial de oxidación a pH 7 es de �0.81 V. Sin embargo, el producto observado en el ánodo es Cl2 y no O2, a causa de un fenómeno llamado sobrevoltaje o sobretensión.
Los experimentos indican que el voltaje necesario para una electrólisis es siempre mayor que el voltaje calculado a partir de potenciales estándar de oxidación y reducción.
El voltaje adicional aplicado es el sobrevoltaje; éste es necesario porque la rapidez de transferencia de electrones en la interfase electrodo-disolución, en una o ambas reacciones de media celda, suele ser lenta, lo que limita la cantidad de corriente que pasa por una celda electrolítica. Para medias reacciones en electrodos donde intervienen disolución o deposición de metales, el sobrevoltaje es muy pequeño; sin embargo, para reacciones de media celda, con formación de O2 o H2 gaseosos, el sobrevoltaje puede llegar hasta a 1 V.
Esta teoría no puede predecir la magnitud del sobrevoltaje; no obstante, se sabe que el sobrevoltaje de formación de O2 es mucho mayor que el de formación de Cl2. A causa del sobrevoltaje, a veces es difícil indicar cuál media reacción sucederá cuando sean similares los valores de E° para medias reacciones alternativas. En esos casos, sólo los experimentos indicarán lo que en realidad sucede.
Las reacciones de electrodo observadas y la reacción global de celda en la electrólisis del cloruro de sodio acuoso son:
El papel del ion sodio es de ion espectador, por lo que no interviene en las reacciones del electrodo. Así, la disolución de cloruro de sodio se convierte en disolución de hidróxido
de sodio al efectuarse la electrólisis. El potencial mínimo requerido para forzar la realización de esta reacción no espontánea, bajo condiciones estándar, es de 2.19 V, más el
sobrevoltaje
Na�(ac) + e�¡Na(s) E° = -2.71 V
Fabricación de cloro e hidróxido de sodio[editar]
La producción de cloro e hidróxido de sodio por electrólisis de cloruro de sodio es la base de la industria cloro-sosa, que en Estados Unidos genera ventas aproximadas por 4 mil millones de dólares. Tanto el cloro como el hidróxido de sodio están entre las principales sustancias químicas en términos de producción: la producción anual estadounidense es de unos 13 millones de toneladas de cloro y de 10 millones de toneladas de hidróxido de sodio. El cloro se usa en el tratamiento de agua y aguas residuales, como blanqueador en la fabricación del papel y en la fabricación de plásticos como el cloruro de polivinilo (PVC). El hidróxido de sodio se emplea en la fabricación de papel, textiles, jabones y detergentes.
La figura que se muestra debajo muestra las propiedades esenciales de una celda de membrana para la producción industrial de cloro e hidróxido de sodio. Una disolución acuosa saturada de cloruro de sodio (salmuera) entra al compartimiento anódico, donde el Cl- se oxida a Cl2 gaseoso, y entra agua al compartimiento del cátodo, donde se convierte en H2 gaseoso y iones OH-. Entre los compartimientos del ánodo y el cátodo está instalada una membrana especial de plástico, permeable sólo a los cationes, pero no a los aniones ni al agua. La membrana mantiene separados al Cl2y a los iones OH-, aunque permite el paso de una corriente de iones Na+ hacia el compartimiento del cátodo, conduciendo así la corriente en la disolución y manteniendo la neutralidad eléctrica en ambos compartimientos. Los iones Na+ y OH- salen del compartimiento del cátodo en forma de una disolución acuosa de NaOH.

FIGURA Una celda de membrana para la
producción electrolítica de Cl2 y NaOH.
El ion cloruro se oxida a Cl2 gaseoso en
el ánodo y el agua se convierte en H2
gaseoso y iones OH- en el cátodo.
- Una manera de producir agua otra vez, es mediante la exposición a un catalizador. El más común es el calor; otro es el platino en forma de lana fina o polvo. El segundo caso debe hacerse con mucho cuidado, incorporando cantidades pequeñas de hidrógeno en presencia de oxígeno y el catalizador, de manera que el hidrógeno se queme suavemente, produciendo una llama tenue. Lo contrario nunca debe hacerse sin debida investigación y ayuda profesional.
- ↑ Chang, Raymond; Goldsby, Kenneth A. (2013). Química. McGRAW-HILL/INTERAMERICANA EDITORES, S.A. DE C.V. ISBN 978-607-15-0928-4.



