Reacción de Japp-Klingemann
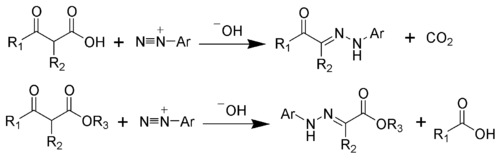
La reacción de Japp-Klingemann es una reacción química utilizada para sintetizar hidrazonas a partir de β-ceto-ácidos (o β-ceto-ésteres) y sales de aril diazonio .[1][2][3][4][5][6] La Reacción está nombrada en honor a los químicos Francis Robert Japp y Felix Klingemann.
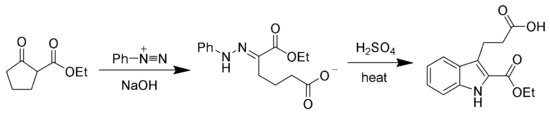
Los productos hidrazónicos de la reacción de Japp–Klingemann son a menudo utilizados como intermediarios en la síntesis de moléculas orgánicas más complejas . Por ejemplo, una fenilhidrazona producida por este métodod puede ser calentada en la presencia de un ácido fuerte para producir un indol vía síntesis de indoles de Fischer .[7][8]
Mecanismo de reacción[editar]
El paso preliminar es la desprotonación del β-ceto-éster. La adición nucleofílica del anion enolato 2 a la sal de diazonio produce el azo compuesto 3. El intermediario 3 ha sido aislado en casos especiales. Aun así, en la mayoría de los casos, la hidrólisis del intermediario 3 produce un intermediario tetraédrico 4, el cual se descompone inmediatamente para liberar el ácido carboxílico 6. Después del intercambio protónico, se forma la hidrazona final 7 .

Referencias[editar]
- ↑ Francis Robert Japp, Felix Klingemann (1887). «Ueber Benzolazo- und Benzolhydrazofettsäuren». Berichte der deutschen chemischen Gesellschaft 20 (2): 2942-2944. doi:10.1002/cber.188702002165.
- ↑ «Zur Kenntniss der Benzolazo- und Benzolhydrazopropionsäuren (p 3284-3286)». Berichte der deutschen chemischen Gesellschaft 20 (2): 3284-3286. 1887. doi:10.1002/cber.188702002234.
- ↑ «Ueber sogenannte »gemischte Azoverbindungen». Berichte der deutschen chemischen Gesellschaft 20 (2): 3398-3401. 1887. doi:10.1002/cber.188702002268.
- ↑ «Ueber die Constitution einiger sogenannten gemischten Azoverbindungen». Liebigs Annalen der Chemie 247 (2): 190-225. 1888. doi:10.1002/jlac.18882470208.
- ↑ Phillips, R. R. Org.
- ↑ Reynolds, G. A.; VanAllan, J. A. Org.
- ↑ «1,3,4,5-Tetrahydrobenz[cd]indoles and related compounds. Part I. A new synthesis of 3,4-dihydrobenz[cd]indol-5(1H)-one (Uhle's ketone)». J. Chem. Soc. Perkins Trans 1: 1121. 1972. doi:10.1039/P19720001121.
- ↑ «Ergoline synthons: Synthesis of 3,4-dihydro-6-methoxybenz[cd]indol-5(1H)-one (6-methoxy-Uhle's ketone) and 3,4-dihydrobenz[cd]indol-5(1H)-one (Uhle's ketone) via a novel decarboxylation of indole-2-carboxylates». J. Org. Chem. 49 (17): 3195-3199. 1984. doi:10.1021/jo00191a028.
