Enlace de tres centros y dos electrones
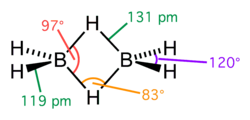
Un enlace de tres centros y dos electrones (3c-2e) es un enlace químico con deficiencia en electrones, donde tres átomos comparten dos electrones. La combinación de tres orbitales atómicos forma tres orbitales moleculares: un orbital enlazante, un orbital no enlazante y un orbital antienlazante. Los dos electrones van en el orbital enlazante, resultando en un efecto neto de enlace y constituyendo un enlace químico entre los tres átomos. En muchos enlaces comunes de este tipo, el orbital de enlace está inclinado hacia dos de los tres átomos, en vez de estar repartido por igual entre los tres. El ejemplo más simple de un enlace 3c-2e es en el ion H3+.[1]
Este tipo de enlace es visto en varios compuestos de boro, como el diborano, B2H6; el monómero BH3 es inestable puesto que el átomo de boro está rodeado por sólo seis electrones de valencia, y entonces, para formar un octeto estable, comparte electrones con un enlace B-H de otro monómero de borano, formando un enlace de 3 centros y 2 electrones B-H-B. En el diborano, hay dos de tales enlaces: dos átomos de hidrógeno (H) hacen puente entre dos átomos de boro (B), dejando dos átomos adicionales formando enlaces ordinarios (de dos centros y dos electrones) en cada átomo de boro.

Este esquema de enlace también se ve en el trimetilaluminio (Al(CH3)3), donde el átomo de carbono de un grupo metilo hace de puente. Este tipo de enlace también ocurre en compuestos de carbono, donde algunas veces se le llama hiperconjugación; otro nombre para los enlaces de tres centros y dos electrones asimétricos.
Las reordenaciones estructurales en carbocationes suceden a través de un estado de transición con enlaces de tres centros. Debido a que las estructuras de enlaces de tres centros tienen aproximadamente la misma energía que los carbocationes, virtualmente no hay energía de activación para estas reordenaciones, así que tienen lugar a velocidades extraordinariamente altas.
Los denominados carbocationes no clásicos tienen enlaces de tres centros y dos electrones. Tal vez la estructura mejor conocida y estudiada de este tipo es el catión norbornilo.
Otro ejemplo de enlace de tres centros electrones y dos electrones es el hidrógeno molecular protonado o catión trihidrógeno, H3+.
