Enlace carbono-flúor
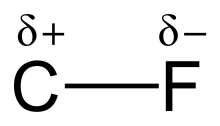
En química orgánica, el enlace carbono-flúor es un enlace entre un átomo de carbono y un átomo de flúor, que es un componente de todos los compuestos organofluorados. Es el enlace más fuerte en química orgánica, y es relativamente corto debido a su carácter iónico parcial. Este enlace también se hace más fuerte y más corto cuando se agregan más átomos de flúor al mismo átomo de carbono, en un compuesto químico. Así, los fluoroalcanos como el tetrafluorometano (tetrafluoruro de carbono) están entre algunos de los compuestos orgánicos más estables.
Electronegatividad y fuerza del enlace
[editar]La alta electronegatividad del flúor (4.0 en la escala de Pauling para el F, y 2,5 para el carbono) le da al enlace carbono-flúor una polaridad/momento dipolar significativos. La densidad electrónica se concentra alrededor del átomo de flúor, dejando al átomo de carbono relativamente pobre en electrones. Esto introduce un carácter iónico al enlace a través de cargas parciales (Cδ+—Fδ−). Las cargas parciales en el átomo de flúor y en el átomo de carbono son atractivas, contribuyendo a la inusual fuerza de enlace del enlace carbono-flúor. Este enlace está etiquetado como "el más fuerte en química orgánica",[1] porque el flúor forma el enlace simple más fuerte con el carbono. Los enlaces cabono-flúor pueden tener una energía de disociación de enlace de hasta 130 kcal/mol.[2] La energía de disociación de enlace (fuerza del enlace) es más alta que los otros enlaces carbono-halógeno y carbono-hidrógeno. Por ejemplo, la molécula representada por CH3X tiene una energía de disociación de enlace de 115 kcal/mol para el enlace carbono-flúor, mientras que los enlaces carbono-X, donde X es hidrógeno, cloro, bromo y yodo, están representados por valores de 104,9, 83,7, 72,1, y 57,6 kcal/mol, respectivamente.[3]
Longitud de enlace
[editar]Típicamente, la longitud de enlace carbono-flúor es aproximadamente 1,35 ángstroms (1,39 Å en el fluorometano).[1] Es más corto que cualquier otro enlace carbono-halógeno, y más corto que los enlaces carbono-nitrógeno y carbono-oxígeno, a pesar de que el flúor tiene una masa atómica mayor. La corta longitud de este enlace puede ser atribuida a las atracciones electrostáticas/carácter iónico entre las cargas parciales en el carbono y el flúor. La longitud de enlace carbono-flúor varía en varias centésimas de ángstrom, dependiendo de la hibridación del átomo de carbono, y la presencia de otros sustituyentes en el carbono, o incluso en átomos lejanos. Estas fluctuaciones pueden ser usadas como indicador de cambios de hibridación sutiles e interacciones estereoelectrónicas. La tabla a continuación muestra cómo la longitud de enlace promedio varía en diferentes medios del enlace (los átomos de carbono están hibridados en sp3, salvo que se indique lo contrario, o en el caso de un carbono aromático).
Enlace Longitud de enlace media (Å)[4] CCH2F, C2CHF 1,399 C3CF 1,428 C2CF2, H2CF2, CCHF2 1,349 CCF3 1,346 FCNO2 1,320 FCCF 1,371 Csp2F 1,340 CarF 1,363 FCarCarF 1,340
La variablidad en las longitudes de enlace y el acortamiento de los enlaces al flúor debido a su carácter iónico parcial también son observados para enlaces entre el flúor y otros elementos, y han sido una fuente de dificultades con la selección de un valor apropiado para el radio covalente del flúor. Originalmente, Linus Pauling sugirió el valor de 64 pm, pero su valor fue en algún momento reemplazado por el de 72 pm, que es la mitad de la longitud del enlace flúor-flúor. Sin embargo, el valor de 72 pm es demasiado largo para ser representativo de las longitudes de los enlaces entre el flúor y otros elementos, así que se ha sugerido valores entre 54 pm y 60 pm.[5][6][7]
Efecto de fuerza de enlace en los enlaces geminales
[editar]A la par que aumenta el número de átomos de flúor en el mismo átomo de carbono (flúor geminal), los otros enlaces se hacen más fuertes y cortos. Esto puede ser visto por los cambios en la longitud de enlace y fuerza (energía de disociación de enlace) para la serie del fluorometano, como se muestra en la tabla inferior; asimismo, las cargas parciales (qC y qF) en los átomos cambian dentro de la serie.[2] La carga parcial en el átomo de carbono se hace más positiva cuando se agregan más átomos de flúor, incrementando las interacciones electrostáticas, y el carácter iónico, entre los átomos de flúor y de carbono.
Compuesto Longitud de enlace C-F (Å) Edis (kcal/mol) qC qF CH3F 1,385 109,9 ± 1 0,01 −0,23 CH2F2 1,357 119,5 0,40 −0,23 CHF3 1.332 127.5 0.56 −0.21 CF4 1,319 130,5 ± 3 0,72 −0,18
Efecto gauche
[editar]
Cuando dos átomos de flúor están en átomos de carbono adyacentes, como en el 1,2-difluoroetano (FCH2CH2F), el confórmero gauche es más estable que el confórmero anti-esto es lo opuesto a lo que normalmente se esperaría ver y lo que es más observado para los etanos 1,2-disustituido; este fenómeno es conocido como el 'efecto gauche.[8] En el 1,2-difluoroetano, la conformación gauche es más estable que la conformación anti por 2,4 a 3,4 kJ/mol en la fase gaseosa. Sin embargo, este efecto no es único al halógeno flúor: el efecto gauche también puede ser observado para el 1,2-dimetoxietano. Un efecto relacionado es el efecto cis en los alquenos. Por ejemplo, el isómero cis del 1,2-difluoroetileno es más estable que el isómero trans.[9]

Existen dos explicaciones principales para el efecto gauche: hiperconjugación y enlaces flexionados. En el modelo de hiperconjugación, se considera que la fuente de la estabilización en el isómero gauche es la donación de densidad electrónica desde el orbital enlazante σ carbono-hidrógeno, hacia el orbital antienlazante σ* carbono-flúor. Debido a la mayor electronegatividad del flúor, el orbital σ carbono-flúor es un mejor donador de electrones que el orbital σ carbono-flúor, mientras que el orbital σ* carbono-flúor es un mejor aceptor de electrones que el orbital σ* carbono-hidrógeno. Sólo la conformación gauche permite un buen traslape entre el mejor donador y el mejor aceptor.
Una clave en la explicación por enlace flexionado del efecto gauche en el difluoroetano es el carácter p incrementado, de los dos enlaces carbono-flúor, debido a la mayor electronegatividad del flúor. Como resultado, se acumula densidad electrónica sobre y debajo de la izquierda y derecha del enlace carbono-carbono central. El traslape de orbitales reducido puede ser parcialmente compensado cuando se asume una conformación gauche, formando un enlace flexionado. De estos dos modelos, se considera que la hiperconjugación es la principal causa detrás del efecto gauche en el difluoroetano.[1][10]
Espectroscopia
[editar]La elongación del enlace carbono-flúor aparece en el espectro infrarrojo entre 1000 y 1360 cm−1. El rango tan amplio es debido a la sensibilidad de la frecuencia de elongación a otros sustituyentes en la molécula. Los compuestos monofluorados tienen una banda fuerte entre 1000 y 1110 cm−1; con más de un átomo de flúor, la banda se divide en dos bandas, una para el modo simétrico, y otra para el modo asimétrico.[11] Las bandas carbono-flúor son tan fuertes que pueden ocultar cualquier banda carbono-hidrógeno que pudiera estar presente.[12]
Los compuestos organofluorados también pueden ser caracterizados utilizando espectroscopia de resonancia magnética nuclear, usando carbono-13, flúor-19 (el único isótopo natural de flúor), o hidrógeno-1 (si está presente). Los corrimientos químicos en 19F-NMR aparecen en un rango muy amplio, dependiendo del grado de sustitución y grupo funcional. La tabla a continuación muestra los rangos de algunas de las clases más grandes.[13]
Tipo de compuesto Rango de corrimiento químico(ppm) relativo a CFCl3 puro F–C=O −70 to −20 CF3 +40 to +80 CF2 +80 to +140 CF +140 to +250 ArF +80 to +170
Véase también
[editar]Referencias
[editar]- ↑ a b c O'Hagan D (febrero de 2008). «Understanding organofluorine chemistry. An introduction to the C–F bond». Chem Soc Rev 37 (2): 308-19. PMID 18197347. doi:10.1039/b711844a.
- ↑ a b Lemal DM. "Perspective on Fluorocarbon Chemistry" J Org Chem. 2004, volume 69, p 1–11. doi 10.1021/jo0302556
- ↑ Blanksby SJ, Ellison GB (abril de 2003). «Bond dissociation energies of organic molecules». Acc. Chem. Res. 36 (4): 255-63. PMID 12693923. doi:10.1021/ar020230d.
- ↑ F. H. Allen, O. Kennard, D. G. Watson, L. Brammer, A. G. Orpen. Tables of bond Lengths determined by X-Ray and Neutron Diffraction. Part 1. Bond Lengths in Organic Compounds. J. Chem. Soc. Perkin Trans. II 1987, S1-S19.
- ↑ Gillespie, Ronald, and Edward Robinson. 1992 Bond Lengths in Covalent Fluorides. A New Value for the Covalent Radius of Fluorine. Inorganic Chemistry, 31, 1960-1963.
- ↑ Robinson, Edward, Samuel Johnson, Ting-Hua Tang, and Ronald Gillespie. 1997. Reinterpretation of the Lengths of Bonds to Fluorine in Terms of an Almost Ionic Model. Inorganic Chemistry, 36, 3022-3030.
- ↑ Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán and Santiago Alvarez. Covalent radii revisited. Dalton Trans., 2008, 2832-2838, doi 10.1039/b801115j
- ↑ Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane Norman C. Craig, Anthony Chen, Ki Hwan Suh, Stefan Klee, Georg C. Mellau, Brenda P. Winnewisser, and Manfred Winnewisser J. Am. Chem. Soc.; 1997; 119(20) pp 4789 - 4790; (Communication) doi 10.1021/ja963819e
- ↑ The stereochemical consequences of electron delocalization in extended .pi. systems. An interpretation of the cis effect exhibited by 1,2-disubstituted ethylenes and related phenomena Richard C. Bingham J. Am. Chem. Soc.; 1976; 98(2); 535-540 Abstract
- ↑ Goodman, L.; Gu, H.; Pophristic, V.. Gauche Effect in 1,2-Difluoroethane. Hyperconjugation, Bent Bonds, Steric Repulsion. J. Phys. Chem. A. 2005, 109, 1223-1229. doi 10.1021/jp046290d
- ↑ George Socrates, Socrates (2001). Infrared and Raman characteristic group frequencies: tables and charts. John Wiley and Sons. p. 198. ISBN 0470093072.
- ↑ Barbara H. Stuart (2004). Infrared Spectroscopy: Fundamentals and Applications. John Wiley and Sons. pp. 82. ISBN 0470854286.
- ↑ https://web.archive.org/web/20080515131118/http://nmr.chem.indiana.edu/NMRguide/misc/19Fshifts.html
