Diferencia entre revisiones de «Triptófano hidroxilasa»
Subtítulo |
Introducción del efecto de la enzima triptófano hidroxilasa en la actividad cerebral |
||
| Línea 98: | Línea 98: | ||
== Implicaciones en la salud == |
== Implicaciones en la salud == |
||
=== Efecto en los transtornos neuropsiquiátricos === |
|||
La triptófano hidroxilasa (TPH), la enzima limitante de la biosíntesis de la neurotransmisión de [[5-Hidroxitriptamina|serotonina 5-HT]](5-hidroxitriptamina), está asociada genéticamente con trastornos psiquiátricos, como la conducta suicida y la depresión, debido a su gran papel en la desregulación de la serotonina cerebral. <ref>{{Cita publicación|url=http://behavioralandbrainfunctions.biomedcentral.com/articles/10.1186/1744-9081-6-49|título=Effect of Tryptophan Hydroxylase-2 rs7305115 SNP on suicide attempts risk in major depression|apellidos=Zhang|nombre=Yuqi|apellidos2=Zhang|nombre2=Changsong|fecha=2010|publicación=Behavioral and Brain Functions|volumen=6|número=1|páginas=49|fechaacceso=2023-10-17|idioma=en|issn=1744-9081|doi=10.1186/1744-9081-6-49|pmc=PMC2939585|pmid=20738857|apellidos3=Yuan|nombre3=Guozhen|apellidos4=Yao|nombre4=Jianjun|apellidos5=Cheng|nombre5=Zaohuo|apellidos6=Liu|nombre6=Chaojun|apellidos7=Liu|nombre7=Qinghai|apellidos8=Wan|nombre8=Gairong|apellidos9=Shi|nombre9=Guizhi}}</ref> |
|||
== Investigación y avances == |
== Investigación y avances == |
||
Revisión del 16:45 17 oct 2023
| triptófano 5-monooxigenasa | ||||
|---|---|---|---|---|
 con Biopterina y Fe3+ unidos | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 1.14.16.4 | |||
| Número CAS | 9037-21-2 | |||
| Ortólogos | ||||
| Especies |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Triptófano hidroxilasa 1 (Triptófano 5-monooxigenasa) | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB |
Lista de códigos PDB 1MLW
| |||
| Identificadores | ||||
| Símbolos | TPH1 (HGNC: 12008) TPRH, TPH | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 1.14.16.4 | |||
| Locus | Cr. 11 p15.3-p14 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Triptófano hidroxilasa 2 | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolo | TPH2 (HGNC: 20692) | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 1.14.16.4 | |||
| Locus | Cr. 12 q15 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
La Triptófano hidroxilasa (TPH) es una enzima implicada en la síntesis del neurotransmisor serotonina. El sistema serotoninérgico es una de loa principales y fundamentales vías neurotransmisoras del cerebro.
Reacción catalizada
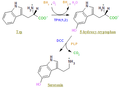
La TPH es una monooxigenasa que incluye dos enzimas distintas, TPH1 y TPH2, así como la tirosina hidroxilasa (TH) y la fenilalanina hidroxilasa (PAH), son miembros de la familia de hidroxilasas de L-aminoácidos aromáticos, que catalizan pasos clave en rutas metabólicas importantes[1][2]. Añade un átomo de oxígeno del oxígeno molecular (O2) al substrato y reduce el otro en forma de agua (H2O). Estas enzimas utilizan tetrahidrobiopterina (BH4) como coenzima que es la encargada de proporcionar los dos electrones necesarios para la reducción del átomo de agua, y hierro (II) no unido a un grupo hemo como cofactor[3], así como oxígeno. La actividad enzimática de la TPH puede regularse mediante varios mecanismos, como la fosforilación por proteína quinasas, Proteína quinasa A, por ejemplo.
La TPH cataliza la siguiente reacción:
L-triptófano + O2 5-Hidroxitriptófano +H2O
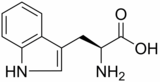
Es responsable de la adición de un grupo hidroxilo a la posición 5 del anillo indólico para formar 5-Hidroxitriptófano (5-HTP), que es la primera etapa paso limitante de la síntesis de serotonina. Esta molécula actúa como neurotransmisora en el cerebro y, además, también es la primera enzima de la ruta de síntesis de melatonina.
A continuación, 5-HTP es descarboxilado por el aminoácido aromático L-decarboxilasa (AADC), dando lugar así a la serotonina y que luego se podrá transformar en melatonina (N-acetyl-5-methoxytriptamina). 5-HTP tiene un papel importante en enfermedades neurológicas y metabólicas.[4]
Función biológica
Estructura y características enzimáticas
Tanto TPH1 como TPH1 (y las otras dos hidroxilasas) presentan una estructura cuaternaria en forma de tetrámero.[5][6] Solo son funcionales por tanto cuando están constituídas por cuatro cadenas polipeptídicas.
Isoformas
En humanos, así como en la mayoría de los vertebrados, hay más de un gen que codifica para varias isoformas de la enzima TPH. En humanos se han descrito dos: la triptófano hidroxilasa 1 (TPH1), localizado en el cromosoma 11, cuyo gen consiste en 10 exones que da lugar a una proteína final con 444 aminoácidos, y la triptófano hidroxilasa (TPH2), en el cromosoma 12, con 11 exones y una longitud de 490 aminoácidos. Ambas conservan una identidad del 71% en su secuencia[7].
- TPH1 se expresa en la mayoría de los tejidos periféricos productores de serotonina: piel, intestino, glándula pineal, corazón, riñones y pulmones. Por tanto, su función principal es la síntesis de la serotonina del resto del organismo exceptuando la del sistema nervioso central, si bien también puede aparecer en este. Eso sí, se ha visto que sus niveles son de 4 a 6 veces inferiores en el cerebro que los de TPH2, de manera que el rol de TPH1 en la síntesis de 5-HT y en la regulación de la conducta y la función cerebral parece ser menos importante que el de TPH2 [8][9].
- TPH2 se expresa exclusivamente en las neuronas productoras de serotonina del núcleo del rafe [10] y es la isoforma principal del sistema nervioso central. Se ha visto que en ratones con deficiencia de TPH1, pero que expresan con normalidad TPH2, la serotonina se sintetiza correctamente en el cerebro, y no hay cambios conductuales respecto a los que presentan niveles más altos de TPH1[11]
Dominios reguladores y catalíticos
Ambas enzimas presentan un núcleo catalítico con forma tetramerizada en el extremo COOH y una dominio terminal en el extremo NH2 que presumiblemente funciona como regulador [12] [13]. El dominio COOH contiene una estructura secundaria en forma de α-hélice de entre 25 y 27 residuos de largo, que es responsable de la tetramerización de esta zona. Todos los residuos involucrados en la actividad enzimática y la unión específica al sustrato se halla en este dominio catalítico, que se calcula que está formado por 300 aminoácidos en todas las proteínas de la familia hidroxilasa[14][15]. Por ello, este dominio adquiere gran importancia en ambas enzimas, ya que es la región encargada de identificar al sustrato, el triptófano en su forma L, e interactuar con él para producir la reacción enzimática de hidroxilación. Así mismo, ambas enzimas, así como el resto de las hidroxilasas (PAH y TH) presentan una secuencia de 5 aminoácidos (Val-Pro-Trp-Phe-Pro) que marcan el inicio del dominio catalítico[16].
Los sitios activos de la zona catalítica son aquellos que se unen a los sustratos, el triptófano, así como al cofactor y a la coenzima en la reacción de hidroxilación. Hay dos histidinas y un glutamato como ligandos al hierro[17][18], que debe estar en forma Fe II para actividad[19]. Por otro lado, BH4 interactúa con las cadenas laterales de un glutamato y una fenilalanina, así como con aminoácidos de la cadena principal. Finalmente, el grupo carboxil del triptófano interactúa con una arginina y un aspartato. La cadena lateral del sustrato aminoácido se mantiene en una bolsa hidrófoba formada por una prolina, una histidina y dos fenilalaninas[20].
En lo que respecta al dominio regulador del extremo terminal NH2, cabe mencionar que el de TPH2 difiere del dominio presente en TPH1, y se ha comprobado su homología al de otra enzima de la familia de las hidroxilasas: TH [21]. Esta estructura presente en TPH2 y TH podría servir para aportar estabilidad a las enzimas, [22] de manera que TPH2, en comparación a TPH1, sería más estable.
Polimorfismos
La actividad enzimática de TPH2 es especialmente susceptible a mutaciones, que provocan una reducción de la actividad de esta enzima. Así, se han identificado polimorfismos funcionales de un solo nucleótido en el gen que codifica para TPH2 que están asociados con trastornos mentales [23][24][25]. Es el caso del polimorfismo Arg441His, que ha resultado en una reducción del 80% de esta enzima al expresarse en un cultivo celular. Así mismo, en este mismo estudio se halló una mayor presencia de la mutación en individuos con trastorno de depresión mayor que en individuos control [26]. Por ello, los polimorfismos de la enzima pueden ser factores de riesgo de trastornos psiquiátricos como TDM [27].
Regulación
Las alteraciones en la actividad de TPH pueden provocar cambios en la cantidad de serotonina liberada en el espacio sináptico y en su estado funcional. Como consecuencia, los tratamientos farmacológicos que modifican esta enzima pueden tener efectos tanto a corto como a largo plazo sobre la serotonina. Debido a la importancia de este neurotransmisor y su relación con distintos trastornos psiquiátricos, se cree que las alteraciones en la actividad de TPH pueden conducir a condiciones clínicamente significativas.[28]
Existen diferentes tratamientos farmacológicos que pueden alterar la actividad de TPH, pero hay algunos que inactivan la enzima y a la vez dañan la serotonina.
- Anfetaminas neurotóxicas: drogas como la metanfetamina y 3,4-metilendioximetanfetamina (MDMA o "Éxtasis") producen una disminución de TPH que puede llegar a ser permanente en el hipocampo. A la vez, aumenta su actividad en el lóbulo frontal (lo que se debe a un intento de compensación por la pérdida de función de la serotonina debido al MDMA).[29]
- L-DOPA: es la terapia más común para tratar Parkinson (consiste en el incremento del nivel de dopamina en el cerebro, que se reduce debido a la degeneración de las neuronas por la enfermedad). La L-DOPA por sí sola no tiene efectos sobre TPH, pero la L-DOPA-quinona sí que inactiva esta enzima. La TPH es una enzima dependiente del hierro, en cambio, L-DOPA (y dopamina) son quelantes de hierro y, por lo tanto, son capaces de inhibirla. También la convierten en una quinoproteína de ciclo redox.[28][30]
También hay sustancias que aumentan la actividad enzimática de TPH1 y TPH2, como algunos corticosteroides (dipropionato de beclometasona, dexametasona, cortisona, prednisolona y betametasona).[31]
Implicaciones en la salud
Efecto en los transtornos neuropsiquiátricos
La triptófano hidroxilasa (TPH), la enzima limitante de la biosíntesis de la neurotransmisión de serotonina 5-HT(5-hidroxitriptamina), está asociada genéticamente con trastornos psiquiátricos, como la conducta suicida y la depresión, debido a su gran papel en la desregulación de la serotonina cerebral. [32]
Investigación y avances
Importancia clínica
En humanos la estimulación de la producción de serotonina o la administración de triptófano tienen efectos antidepresivos[cita requerida] y la inhibición de la TPH (por ejemplo, por administración de p-Clorofenilalanina) puede desencadenar episodios depresivos.[33]
Riesgo suicida
Imágenes adicionales
-
Síntesis de serotonina a partir de tryptófano
-
Vía metabólica desde el triptófano a seronina
Referencias
- ↑ McKinney J, Teigen K, Frøystein NA, Salaün C, Knappskog PM, Haavik J, Martínez A (diciembre de 2001). «Conformation of the substrate and pterin cofactor bound to human tryptophan hydroxylase. Important role of Phe313 in substrate specificity». Biochemistry 40 (51): 15591-601. PMID 11747434. doi:10.1021/bi015722x. Archivado desde el original el 17 de diciembre de 2008.
- ↑ Walther, Diego J.; Bader, Michael (2003-11). «A unique central tryptophan hydroxylase isoform». Biochemical Pharmacology (en inglés) 66 (9): 1673-1680. doi:10.1016/S0006-2952(03)00556-2. Consultado el 14 de octubre de 2023.
- ↑ Haavik, J., Toska, K., Tyrosine Hydroxylase and Parkinson’s Disease. Molecular Neurobiology, 1998. 16(3) :p.285-309.
- ↑ Maffei, Massimo E. (26 de diciembre de 2020). «5-Hydroxytryptophan (5-HTP): Natural Occurrence, Analysis, Biosynthesis, Biotechnology, Physiology and Toxicology». International Journal of Molecular Sciences 22 (1): 181. ISSN 1422-0067. PMC 7796270. PMID 33375373. doi:10.3390/ijms22010181. Consultado el 17 de octubre de 2023.
- ↑ Kumer, Sean C.; Vrana, Kent E. (23 de noviembre de 2002). «Intricate Regulation of Tyrosine Hydroxylase Activity and Gene Expression». Journal of Neurochemistry (en inglés) 67 (2): 443-462. doi:10.1046/j.1471-4159.1996.67020443.x. Consultado el 14 de octubre de 2023.
- ↑ Mockus, Susan M.; Vrana, Kent E. (1998-06). «Advances in the molecular characterization of tryptophan hydroxylase». Journal of Molecular Neuroscience (en inglés) 10 (3): 163-179. ISSN 0895-8696. doi:10.1007/BF02761772. Consultado el 14 de octubre de 2023.
- ↑ Walther DJ, Bader M (noviembre de 2003). «A unique central tryptophan hydroxylase isoform». Biochem. Pharmacol. 66 (9): 1673-80. PMID 14563478. doi:10.1016/S0006-2952(03)00556-2.
- ↑ Zill, P.; Buttner, A.; Eisenmenger, W.; Moller, H.; Ackenheil, M.; Bondy, B. (2007-01). «Analysis of tryptophan hydroxylase I and II mRNA expression in the human brain: A post-mortem study». Journal of Psychiatric Research (en inglés) 41 (1-2): 168-173. doi:10.1016/j.jpsychires.2005.05.004. Consultado el 14 de octubre de 2023.
- ↑ Perroud, Nader; Neidhart, Elizabeth; Petit, Brice; Vessaz, Monique; Laforge, T.; Relecom, C.; La Harpe, Romano; Malafosse, Alain et al. (2010). «Simultaneous analysis of serotonin transporter, tryptophan hydroxylase 1 and 2 gene expression in the ventral prefrontal cortex of suicide victims». American Journal of Medical Genetics Part B: Neuropsychiatric Genetics (en inglés). 9999B: n/a-n/a. doi:10.1002/ajmg.b.31059. Consultado el 14 de octubre de 2023.
- ↑ Patel, Paresh D; Pontrello, Crystal; Burke, Sharon (2004-02). «Robust and tissue-specific expression of TPH2 versus TPH1 in rat raphe and pineal gland». Biological Psychiatry 55 (4): 428-433. ISSN 0006-3223. doi:10.1016/j.biopsych.2003.09.002. Consultado el 14 de octubre de 2023.
- ↑ Walther, Diego J.; Peter, Jens-Uwe; Bashammakh, Saleh; Hörtnagl, Heide; Voits, Mechthild; Fink, Heidrun; Bader, Michael (3 de enero de 2003). «Synthesis of Serotonin by a Second Tryptophan Hydroxylase Isoform». Science (en inglés) 299 (5603): 76-76. ISSN 0036-8075. doi:10.1126/science.1078197. Consultado el 14 de octubre de 2023.
- ↑ Fitzpatrick, Paul F. (1999-06). «Tetrahydropterin-Dependent Amino Acid Hydroxylases». Annual Review of Biochemistry (en inglés) 68 (1): 355-381. ISSN 0066-4154. doi:10.1146/annurev.biochem.68.1.355. Consultado el 14 de octubre de 2023.
- ↑ Grenett, H E; Ledley, F D; Reed, L L; Woo, S L (1987-08). «Full-length cDNA for rabbit tryptophan hydroxylase: functional domains and evolution of aromatic amino acid hydroxylases.». Proceedings of the National Academy of Sciences (en inglés) 84 (16): 5530-5534. ISSN 0027-8424. PMC 298896. PMID 3475690. doi:10.1073/pnas.84.16.5530. Consultado el 17 de octubre de 2023.
- ↑ Daubner, S. Colette; Lohse, Daniel L.; Fitzpatrick, Paul F. (1993-09). «Expression and characterization of catalytic and regulatory domains of rat tyrosine hydroxylase». Protein Science (en inglés) 2 (9): 1452-1460. PMC 2142459. PMID 8104613. doi:10.1002/pro.5560020909. Consultado el 17 de octubre de 2023.
- ↑ Moran, Graham R.; Derecskei-Kovacs, Agnes; Hillas, Patrick J.; Fitzpatrick, Paul F. (1 de mayo de 2000). «On the Catalytic Mechanism of Tryptophan Hydroxylase». Journal of the American Chemical Society (en inglés) 122 (19): 4535-4541. ISSN 0002-7863. doi:10.1021/ja994479a. Consultado el 17 de octubre de 2023.
- ↑ Lohse, D.L.; Fitzpatrick, P.F. (1993-12). «Identification of the Intersubunit Binding Region in Rat Tyrosine Hydroxylase». Biochemical and Biophysical Research Communications (en inglés) 197 (3): 1543-1548. doi:10.1006/bbrc.1993.2653. Consultado el 17 de octubre de 2023.
- ↑ Goodwill, Kenneth E.; Sabatier, Christelle; Marks, Cara; Raag, Reetta; Fitzpatrick, Paul F.; Stevens, Raymond C. (1997-07). «Crystal structure of tyrosine hydroxylase at 2.3 Å and its implications for inherited neurodegenerative diseases». Nature Structural Biology 4 (7): 578-585. ISSN 1072-8368. doi:10.1038/nsb0797-578. Consultado el 17 de octubre de 2023.
- ↑ Wang, Lin; Erlandsen, Heidi; Haavik, Jan; Knappskog, Per M.; Stevens, Raymond C. (1 de octubre de 2002). «Three-Dimensional Structure of Human Tryptophan Hydroxylase and Its Implications for the Biosynthesis of the Neurotransmitters Serotonin and Melatonin ,». Biochemistry (en inglés) 41 (42): 12569-12574. ISSN 0006-2960. doi:10.1021/bi026561f. Consultado el 17 de octubre de 2023.
- ↑ Fitzpatrick, Paul F. (1989-05). «The metal requirement of rat tyrosine hydroxylase». Biochemical and Biophysical Research Communications (en inglés) 161 (1): 211-215. doi:10.1016/0006-291X(89)91582-9. Consultado el 17 de octubre de 2023.
- ↑ Moran, Graham R.; Derecskei-Kovacs, Agnes; Hillas, Patrick J.; Fitzpatrick, Paul F. (1 de mayo de 2000). «On the Catalytic Mechanism of Tryptophan Hydroxylase». Journal of the American Chemical Society (en inglés) 122 (19): 4535-4541. ISSN 0002-7863. doi:10.1021/ja994479a. Consultado el 17 de octubre de 2023.
- ↑ McKinney, Jeffrey; Knappskog, Per M; Pereira, Jacinto; Ekern, Trude; Toska, Karen; Kuitert, Baukje B.; Levine, David; Gronenborn, Angela M. et al. (2004-02). «Expression and purification of human tryptophan hydroxylase from Escherichia coli and Pichia pastoris». Protein Expression and Purification (en inglés) 33 (2): 185-194. doi:10.1016/j.pep.2003.09.014. Consultado el 14 de octubre de 2023.
- ↑ Mockus, Susan M.; Kumer, Sean C.; Vrana, Kent E. (1997-06). «A chimeric tyrosine/tryptophan hydroxylase: The tyrosine hydroxylase regulatory domain serves to stabilize enzyme activity». Journal of Molecular Neuroscience (en inglés) 9 (1): 35-48. ISSN 0895-8696. doi:10.1007/BF02789393. Consultado el 14 de octubre de 2023.
- ↑ Zill, P; Baghai, T C; Zwanzger, P; Schüle, C; Eser, D; Rupprecht, R; Möller, H-J; Bondy, B et al. (1 de noviembre de 2004). «SNP and haplotype analysis of a novel tryptophan hydroxylase isoform (TPH2) gene provide evidence for association with major depression». Molecular Psychiatry (en inglés) 9 (11): 1030-1036. ISSN 1359-4184. doi:10.1038/sj.mp.4001525. Consultado el 14 de octubre de 2023.
- ↑ Zhang, Xiaodong; Gainetdinov, Raul R.; Beaulieu, Jean-Martin; Sotnikova, Tatyana D.; Burch, Lauranell H.; Williams, Redford B.; Schwartz, David A.; Krishnan, K.Ranga R. et al. (2005-01). «Loss-of-Function Mutation in Tryptophan Hydroxylase-2 Identified in Unipolar Major Depression». Neuron (en inglés) 45 (1): 11-16. doi:10.1016/j.neuron.2004.12.014. Consultado el 14 de octubre de 2023.
- ↑ Zhou, Zhifeng; Roy, Alec; Lipsky, Robert; Kuchipudi, Kavi; Zhu, Guanshan; Taubman, Julie; Enoch, Mary-Anne; Virkkunen, Matti et al. (1 de octubre de 2005). «Haplotype-Based Linkage of Tryptophan Hydroxylase 2 to Suicide Attempt, Major Depression, and Cerebrospinal Fluid 5-Hydroxyindoleacetic Acid in 4 Populations». Archives of General Psychiatry (en inglés) 62 (10): 1109. ISSN 0003-990X. doi:10.1001/archpsyc.62.10.1109. Consultado el 14 de octubre de 2023.
- ↑ Zhang, X.; Beaulieu, J.-M.; Gainetdinov, R. R.; Caron, M. G. (2006-01). «Functional polymorphisms of the brain serotonin synthesizing enzyme tryptophan hydroxylase-2». Cellular and Molecular Life Sciences (en inglés) 63 (1). ISSN 1420-682X. doi:10.1007/s00018-005-5417-4. Consultado el 14 de octubre de 2023.
- ↑ Haghighi, F; Bach-Mizrachi, H; Huang, Y Y; Arango, V; Shi, S; Dwork, A J; Rosoklija, G; Sheng, H T et al. (2008-08). «Genetic architecture of the human tryptophan hydroxylase 2 Gene: existence of neural isoforms and relevance for major depression». Molecular Psychiatry (en inglés) 13 (8): 813-820. ISSN 1359-4184. doi:10.1038/sj.mp.4002127. Consultado el 14 de octubre de 2023.
- ↑ a b Kuhn, Donald M. (1999). Huether, Gerald, ed. Tryptophan Hydroxylase Regulation Drug-Induced Modifications that Alter Serotonin Neuronal Function. Advances in Experimental Medicine and Biology (en inglés). Springer US. pp. 19-27. ISBN 978-1-4615-4709-9. doi:10.1007/978-1-4615-4709-9_3. Consultado el 15 de octubre de 2023.
- ↑ García-Osta, Ana; Del Río, Joaquín; Frechilla, Diana (26 de julio de 2004). «Increased CRE-binding activity and tryptophan hydroxylase mRNA expression induced by 3,4-methylenedioxymethamphetamine (MDMA, "ecstasy") in the rat frontal cortex but not in the hippocampus». Brain Research. Molecular Brain Research 126 (2): 181-187. ISSN 0169-328X. PMID 15249142. doi:10.1016/j.molbrainres.2004.04.006. Consultado el 15 de octubre de 2023.
- ↑ Kuhn, D. M.; Arthur, R. E. (10 de noviembre de 1999). «L-DOPA-quinone inactivates tryptophan hydroxylase and converts the enzyme to a redox-cycling quinoprotein». Brain Research. Molecular Brain Research 73 (1-2): 78-84. ISSN 0169-328X. PMID 10581400. doi:10.1016/s0169-328x(99)00238-7. Consultado el 15 de octubre de 2023.
- ↑ Betari, Nibal; Teigen, Knut; Sahlholm, Kristoffer; Haavik, Jan (2021-09). «Synthetic corticosteroids as tryptophan hydroxylase stabilizers». Future Medicinal Chemistry 13 (17): 1465-1474. ISSN 1756-8919. doi:10.4155/fmc-2021-0068. Consultado el 17 de octubre de 2023.
- ↑ Zhang, Yuqi; Zhang, Changsong; Yuan, Guozhen; Yao, Jianjun; Cheng, Zaohuo; Liu, Chaojun; Liu, Qinghai; Wan, Gairong et al. (2010). «Effect of Tryptophan Hydroxylase-2 rs7305115 SNP on suicide attempts risk in major depression». Behavioral and Brain Functions (en inglés) 6 (1): 49. ISSN 1744-9081. PMC 2939585. PMID 20738857. doi:10.1186/1744-9081-6-49. Consultado el 17 de octubre de 2023.
- ↑ Wang L, Erlandsen H, Haavik J, Knappskog PM, Stevens RC (octubre de 2002). «Three-dimensional structure of human tryptophan hydroxylase and its implications for the biosynthesis of the neurotransmitters serotonin and melatonin». Biochemistry 41 (42): 12569-74. PMID 12379098. doi:10.1021/bi026561f.
Léase también
- Friedman PA, Kappelman AH, Kaufman S (1972). «Partial purification and characterization of tryptophan hydroxylase from rabbit hindbrain». J. Biol. Chem. 247 (13): 4165-73. PMID 4402511.
- Hamon M, Bourgoin S, Artaud F, Glowinski J (1979). «The role of intraneuronal 5-HT and of tryptophan hydroxylase activation in the control of 5-HT synthesis in rat brain slices incubated in K+-enriched medium». J. Neurochem. 33 (5): 1031-42. PMID 315449. doi:10.1111/j.1471-4159.1979.tb05239.x.
- Ichiyama A, Nakamura S, Nishizuka Y, Hayaishi O (1970). «Enzymic studies on the biosynthesis of serotonin in mammalian brain». J. Biol. Chem. 245 (7): 1699-709. PMID 5309585.
- Jequier E, Robinson DS, Lovenberg W, Sjoerdsma A (1969). «Further studies on tryptophan hydroxylase in rat brainstem and beef pineal». Biochem. Pharmacol. 18 (5): 1071-81. PMID 5789774. doi:10.1016/0006-2952(69)90111-7.
- Wang L, Erlandsen H, Haavik J, Knappskog PM, Stevens RC (2002). «Three-dimensional structure of human tryptophan hydroxylase and its implications for the biosynthesis of the neurotransmitters serotonin and melatonin». Biochemistry. 41 (42): 12569-74. PMID 12379098. doi:10.1021/bi026561f.
- Windahl MS, Petersen CR, Christensen, HEM, Harris P (2008). «Crystal Structure of Tryptophan Hydroxylase with Bound Amino Acid Substrate». Biochemistry. 47 (46): 12087-94. PMID 18937498. doi:10.1021/bi8015263.
Enlaces externos
- MeSH: Tryptophan+Hydroxylase (en inglés)
- Véase también tryptophan hydroxylase in Proteopedia