Diferencia entre revisiones de «Fibra muscular»
→Recambio celular: Texto aclaratorio |
→Recambio celular: Texto con Referencia |
||
| Línea 69: | Línea 69: | ||
== Recambio celular == |
== Recambio celular == |
||
Las células del [[músculo esquelético]] están diferenciadas terminalmente, debido a su especialización en la función contráctil. Los miocitos y las "células periféricas" o "satélites" están en estrecho contacto y constituyen una unidad funcional. |
Las células del [[músculo esquelético]] están diferenciadas terminalmente, debido a su especialización en la función contráctil. Los miocitos y las "células periféricas" o "satélites" están en estrecho contacto y constituyen una unidad funcional. |
||
| ⚫ | |||
=== Células satélites === |
|||
| ⚫ | {{cita publicación |autores= Pajalunga D., Puggioni E.M.R., Mazzola A., Leva V., Montecucco A., Crescenzi M.|año= 2010 |título= DNA Replication Is Intrinsically Hindered in Terminally Differentiated Myotubes |publicación= PLoS ONE |volumen= 5 |número= 7 |página= e11559 |
||
Las "células satélite" representan una población heterogénea, formada por células madre y células progenitoras, localizadas entre la lámina basal y el sarcolema de cada fibra muscular.<br> |
|||
Las "células satélite" son responsables de: el crecimiento, la reparación y la regeneración de la fibra muscular.<ref name="Kaspar,2013">{{cita publicación |autores= Kaspar P., Ilencikova K., Zikova M., Horvath O., Cermak V., Bartunek P., Strand H. |año= 2013 |título= c-Myb Inhibits Myoblast Fusion |publicación= PLoS ONE |volumen= 8 |número= 10 |página= e76742 |doi= 10.1371/journal.pone.0076742 |
|||
|url= https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0076742 |fechaacceso= 1 de febrero de 2020}}</ref> |
|||
| ⚫ | |||
| ⚫ | {{cita publicación |autores= Pajalunga D., Puggioni E.M.R., Mazzola A., Leva V., Montecucco A., Crescenzi M.|año= 2010 |título= DNA Replication Is Intrinsically Hindered in Terminally Differentiated Myotubes |publicación= PLoS ONE |volumen= 5 |número= 7 |página= e11559 |doi= 10.1371/journal.pone.0011559 |url= https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0011559 |
||
|fechaacceso= 1 de febrero de 2020}}</ref> |
|fechaacceso= 1 de febrero de 2020}}</ref> |
||
Revisión del 15:04 2 feb 2020

La fibra muscular o miocito esquelético[1] es una célula multinucleada o sincitio, cilíndrica y con capacidad contráctil y de la cual está compuesto el músculo esquelético.
La principal propiedad de esta célula es la contractilidad, es decir: la capacidad de acortar su propia longitud desarrollando un trabajo al hacerlo.
[2]
Embriología

El miocito se desarrolla a partir de la hoja germinativa llamada mesodermo. Las células precursoras son denominadas mioblastos y poseen un solo núcleo. Estos mioblastos individuales se fusionan y forman fibras alargadas multinucleadas.[3]

Cuando los mioblastos se fusionan, forman sincitios multinucleados, denominados miotubos. Estos miotubos presentan numerosos núcleos centrales, que luego se separan y se mueven hacia la periferia cuando maduran.[4]
En el humano dentro del citoplasma aparecen las miofibrillas y al tercer mes son visibles las estriaciones.
Estructura
El miocito esquelético (llamado también fibra muscular) es la unidad estructural del músculo estriado, muestra un diámetro de 40-100 μm y su longitud llega a
varios centímetros.[5]
Esta célula contiene orgánulos, varios núcleos celulares,
mioglobina y un complejo entramado proteico de fibras llamadas actina y miosina, cuya principal propiedad es la contractilidad.
Microarquitectura

Con microscopía óptica en el miocito se hace visible, su característica más saliente: la presencia de una sucesión de estrías claras y oscuras, en el sector central de su citoplasma. Las estrías se presentan de forma perpendicular al eje mayor del miocito. Están formadas por la alternancia de zonas claras y oscuras dentro de cada miofibrilla.[6]

La fibra muscular, está rodeada por una membrana celular que se denomina sarcolema. Esta membrana plasmática de los miocitos esqueléticos, presenta numerosas invaginaciones para formar los llamados túbulos T. [7]
El retículo endoplásmico del miocito recibe el nombre de retículo
sarcoplasmático.
Las mitocondrias son muy abundantes y se disponen en los espacios entre las miofibrillas.

Los núcleos celulares son múltiples, se disponen en la periferia de la célula esquelética, inmediatamente debajo del sarcolema. Son aplanados y ovalados de 10 μm de longitud y 4 μm de ancho.
Ultraestructura



Con el microscopio electrónico, la fibra muscular esquelética se caracteriza por: tener una organización intracelular muy compleja y por mostrar una disposición específica de los orgánulos con relación a la anatomía del sarcómero.[8]
En el miocito de mamífero los túbulos y cisternas del retículo forman una estructura llamada tríada.
Una tríada se compone de: un túbulo T centrado entre dos cisternas terminales del retículo sarcoplasmático (RS).
Las tríadas se ubican en la inmediata cercanía de la línea Z, en la unión de dos sarcómeros adyacentes de una miofibrilla. Estas estructuras tubulares están acompañadas por mitocondrias.[5]

Las mitocondrias se disponen en los espacios entre las miofibrillas, esto determina que estén estrechamente empacadas y en contacto entre ellas. Se encuentran en inmediata cercanía de las miofibrillas para facilitar la difusión de moléculas y son muy abundantes en esta célula, para aportar la energía que necesita la contracción.

Los núcleos celulares múltiples son alargados y estrechos con indentaciones. Tienen forma ovalada, una longitud media de 8-10 μm y su número puede superar los varios centenares a lo largo de una célula fibra muscular.
La cromatina es clara en el centro, con pocos centros de condensación periféricos sobre la membrana nuclear.[7] [9]
El citoplasma del miocito llamado sarcoplasma, es complejo y característico, por mostrar una gran especialización celular.[6]

El citoesqueleto, está principalmente formado por actina filamentosa, que se asocia con una proteína contráctil: la miosina II. Ambas proteínas estructuran los sectores llamados sarcómeros y éstos se unen de manera repetitiva para formar los haces intracelulares denominados miofibrillas.

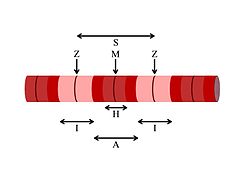
La miofibrilla observada al microscopio, exhibe bandas oscuras (la banda "A") y bandas claras (la banda "I"). La banda clara I es intersecada por una línea llamada línea "Z". A su vez, la banda oscura A es intersecada por la línea "M". Entre la banda oscura A y la línea M que la intersecta está un espacio claro llamado zona "H". Todas estas bandas y líneas no son más que la organización de la maquinaria contráctil de la fibra muscular llamada sarcómero, la cual se extiende desde una línea Z hasta la siguiente.
La banda I del sarcómero no es más que un grupo de fibras de actina una al lado de la otra. La banda A contiene las fibras de miosina, las cuales son ciertamente más gruesas que las de actina. Ambas fibras se superimponen en el espacio de la banda A.

Las distrofias musculares, que son las miopatías más frecuentes, provocan una degeneración progresiva del miocito (fibras musculares).
Recambio celular
Las células del músculo esquelético están diferenciadas terminalmente, debido a su especialización en la función contráctil. Los miocitos y las "células periféricas" o "satélites" están en estrecho contacto y constituyen una unidad funcional.
Células satélites
Las "células satélite" representan una población heterogénea, formada por células madre y células progenitoras, localizadas entre la lámina basal y el sarcolema de cada fibra muscular.
Las "células satélite" son responsables de: el crecimiento, la reparación y la regeneración de la fibra muscular.[10]
La diferenciación terminal del miocito, está definida por su salida del ciclo mitótico de manera permanente. Esta salida tiene lugar mientras adquiere las características de su especialización funcional.[11]
Véase también
Referencias
- ↑ OPS, OMS. Biblioteca virtual de salud: Descriptores en Ciencias de la Salud (ed.). «Fibras Musculares Esqueléticas/Fibras del Músculo/Miocitos Esqueléticos». Consultado el 16 de enero de 2020.
- ↑ Guyton , A.C. ; Hall, J.E. (2011). Textbook of Medical Physiology [Tratado de fisiología médica ] (12ª edición). Barcelona: Elsevier/GEA Consultoría Editorial. ISBN 9788480868198. Consultado el 22 de abril de 2013.
- ↑ Sadler T.W., Langman J. (2007). «Cap10: Sistema muscular». Embriología médica Con orientación clínica. Médica Panamericana. p. 149. Consultado el 31 de enero de 2020.
- ↑ Cadot B.; Gache V.; Gomes E.R. (2015). «Moving and positioning the nucleus in skeletal muscle –one step at a time». Nucleus 6 (5): 373-381. Consultado el 31 de enero de 2020.
- ↑ a b Welsch U.; Sobotta J. (2008). «cap3: Tejidos. Tejido muscular esquelético». Histología. Médica Panamericana. p. 157. Consultado el 16 de enero de 2020.
- ↑ a b Megías M., Molist P., Pombal M.A. . «Tipos celulares. Muscular esquelético. Miocito». Atlas de histología vegetal y animal. Consultado el 16 de enero de 2020.
- ↑ a b Kühnel W. (2005). «Imagen 230 y 231». Atlas color de citología e histología (11° edición). Médica Panamericana. pp. 167-169. Consultado el 17 de enero de 2020.
- ↑ Guarnieri S, Morabito C, Paolini C, Boncompagni S, Pilla R, Fanò-Illic G, (2013). Growth Associated Protein 43 Is Expressed in Skeletal Muscle Fibers and Is Localized in Proximity of Mitochondria and Calcium Release Units. 8 (1). PLoS ONE. p. e53267. doi:10.1371/journal.pone.0053267. Consultado el 19 de enero de 2020.
- ↑ Roman W., Gomes E.R. (2018). «Nuclear positioning in skeletal muscle». Seminars in Cell & Developmental Biology 82: 51-56.
- ↑ Kaspar P., Ilencikova K., Zikova M., Horvath O., Cermak V., Bartunek P., Strand H. (2013). «c-Myb Inhibits Myoblast Fusion». PLoS ONE 8 (10): e76742. doi:10.1371/journal.pone.0076742. Consultado el 1 de febrero de 2020.
- ↑ Pajalunga D., Puggioni E.M.R., Mazzola A., Leva V., Montecucco A., Crescenzi M. (2010). «DNA Replication Is Intrinsically Hindered in Terminally Differentiated Myotubes». PLoS ONE 5 (7): e11559. doi:10.1371/journal.pone.0011559. Consultado el 1 de febrero de 2020.
