Síntesis de indoles de Fukuyama
La Síntesis de indoles de Fukuyama es método de síntesis orgánica que consiste en hacer reaccionar alqueniltioanilidas para obtener indoles 2,3-disustituidos.[1] Por lo general, el hidruro de tributilestaño se utiliza como agente reductor, con azobisisobutironitrilo (AIBN) como iniciador de radicales libres.

Ya que es uno de los métodos más simples para sintetizar indoles polisustituidos, este procedimiento ha sido utilizado en numerosas síntesis de productos naturales, incluyendo aspidofitina,[2] vinblastina[3] y la estricnina.[4]
Mecanismo
[editar]El mecanismo de reacción comienza con la creación del radical tributil estaño con AIBN o trietilborano, que no se muestra en ningún mecanismo por etapas. Después de los ataques radicales, el carbono o-isocianico crea el radical alfa-estannoimidoilo. Mediante la ciclación radical se forma un anillo de cinco miembros seguido de la propagación de un nuevo radical estaño. El paso final depende del resultado deseado de la reacción. Esta reacción es una síntesis de un recipiente y produce rendimientos que varían del 50% al 98%, dependiendo del sustituyente.[5]

El mecanismo que usa 2-alqueniltioanilida es muy similar, comenzando también con la formación de un enlace, ahora entre el radical estaño y el azufre. Seguido de una ciclación radical similar que resulta en un anillo de cinco miembros, se produce un nuevo radical de estaño y el radical atacante original se va con el sustituyente de azufre. Esta parte del mecanismo paso a paso aún no se ha detallado. El rendimiento de la reacción puede variar del 40% al 93% dependiendo también del sustituyente deseado.

Derivados
[editar]La síntesis de Fukuyama Indole puede generar un rango de diferentes sustituyentes en la posición 2,3 que antes no se podían obtener sin un grupo protector en el nitrógeno en el anillo. Un ejemplo de ello es el derivado de 2-yodoindol, que puede conducir a una variedad de indoles sustituidos 2,3 no protegidos con N. Antes del descubrimiento de este compuesto, la química que involucraba 2-stannylindoles no se desarrolló ya que no había forma de sintetizar prácticamente estos 2,3-stannylindoles sin protección N. Uno se limitó a la producción de 2-stannylindoles N-protegidos a través de la metalación mediante un proceso conocido como acoplamiento de Stille. [6] Los 2-estanilindol no protegidos N generados a partir de la síntesis de Fukuyama se pueden oxidar fácilmente con yodo abriendo un área química que permite la síntesis de una variedad de compuestos que utilizan los 2-yodoindol como reactivo de partida. Este derivado sustituido con yodo puede conducir a haluros de arilo, yoduros de vinilo, triflatos de vinilo, bromuros de bencilo.

Además de acetilenos (acoplamiento de Sonogashira) y acrilatos (reacción de Heck) en la segunda posición.[6]

Aplicaciones
[editar]La síntesis es uno de los métodos más simples para crear indoles polisustituidos, este procedimiento se ha utilizado en numerosas síntesis de productos naturales, incluyendo aspidofitina,[7] vinblastina,[8] y estricnina.[9]
A continuación se muestra el cuarto paso en la síntesis de (+) - Vinblastina, la aplicación de la síntesis de Fukuyama Indole para crear un indol disustituido.
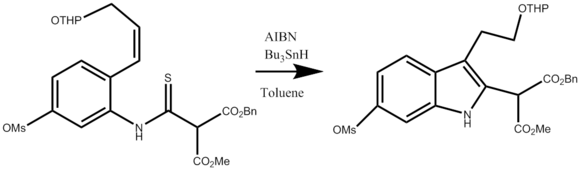
Además, la reacción de fukuyama desempeña un papel en las síntesis de indolocarbazoles,[10] biindolilos,[10] y en la síntesis total de vincadiformina y tabersonina.[11]
Véase también
[editar]Referencias
[editar]- ↑ Tokuyama, H; Yamashita, T; Reding, M. T; Kaburagi, Y; Fukuyama, T (1999). «Radical Cyclization of 2-Alkenylthioanilides: A Novel Synthesis of 2,3-Disubstituted Indoles». J. Am. Chem. Soc. 121: 3791-3792. doi:10.1021/ja983681v.
- ↑ Sumi, S; Matsumoto, K; Tokuyama, H; Fukuyama, T (2003). «Enantioselective Total Synthesis of Aspidophytine». Org. Lett. 5 (11): 1891-1893. PMID 12762679. doi:10.1021/ol034445e.
- ↑ Yokoshima, S; Ueda, T; Kobayashi, S; Sato, A; Kuboyama, T; Tokuyama, H; Fukuyama, T (2002). «Stereocontrolled Total Synthesis of (+)-Vinblastine». J. Am. Chem. Soc. 124: 2137-2139. doi:10.1021/ja0177049.
- ↑ Kaburagi, Y; Tokuyama, H; Fukuyama, T (2004). «Total Synthesis of (-)-Strychnine». J. Am. Chem. Soc. 126 (33): 10246-10247. PMID 15315428. doi:10.1021/ja046407b.
- ↑ Fukuyama, T.; Chen, X.; Peng, G. (1994). «A Novel Tin-Mediated Indole Synthesis». J. Am. Chem. Soc. 116 (7): 3127-8. doi:10.1021/ja983681v.
- ↑ Trost, B. M.; Fortunak, J. M. (1982). «Cyclizations initiated by a Pd2+-Ag+ mixed-metal system». Organometallics 1 (7): 7-10. doi:10.1021/om00061a003.
- ↑ Sumi, S.; Matsumoto, K.; Tokuyama, H.; Fukuyama, T. (2003). «Enantioselective Total Synthesis of Aspidophytine». Org. Lett. 5 (11): 1891-3. PMID 12762679. doi:10.1021/ol034445e.
- ↑ Yokoshima, S.; Ueda, T.; Kobayashi, S.; Sato, A.; Kuboyama, T.; Tokuyama, H.; Fukuyama, T. (2002). «Stereocontrolled Total Synthesis of (+)-Vinblastine». J. Am. Chem. Soc. 124 (10): 2137-9. doi:10.1021/ja0177049. Parámetro desconocido
|citeseerx=ignorado (ayuda) - ↑ Kaburagi, Y.; Tokuyama, H.; Fukuyama, T. (2004). «Total Synthesis of (−)-Strychnine». J. Am. Chem. Soc. 126 (33): 10246-7. PMID 15315428. doi:10.1021/ja046407b.
- ↑ a b Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasKobayashi - ↑ Kobayashi, S.; Peng, G.; Fukuyama, T. (1999). «Efficient total syntheses of (±)-vincadifformine and (−)-tabersonine». Tetrahedron Lett. 40 (8): 1519-22. doi:10.1016/S0040-4039(98)02667-7.
