Diferencia entre revisiones de «Plaqueta»
m BOT - Posible vandalismo de 190.128.230.66, revirtiendo hasta la edición 30216141 de MastiBot. ¿Hubo un error? |
|||
| Línea 16: | Línea 16: | ||
== Plasma Rico en Plaquetas (PRP) == |
== Plasma Rico en Plaquetas (PRP) == |
||
La preparación del plasma rico en plaquetas (PRP) de |
La preparación del plasma rico en plaquetas (PRP) de gille puto, requiere la colección de sangre periférica del paciente, la separación de las plaquetas y el plasma de los otros elementos celulares sanguíneos, y la polimerización de la fibrina del plasma para concentrar las plaquetas en un gel-rico en plaquetas con suficiente estabilidad como para ser implantado quirúrgicamente. Actualmente, algunos métodos comerciales para la preparación del PRP utilizan calcio y trombina bovina<ref>McAleer JP, Sharma S, Kaplan EM, Perisch G. Use of autologous platelet concentrate in a nonhealing lower extremity wound. Adv Skin Wound Care 2006; 19:354-63.</ref><ref>Driver VR, Hanft J, Fylling CP, Beriou JM. Arospective, randomized, controlled trial of autologous platelet-rich plasma gel for the treatment of diabetic foot ulcers. Ostomy Wound Manage 2006;52:68-87.</ref> o bien, trombina preparada de forma autóloga para crear una matriz rica en plaquetas y fibrina (PRFM del inglés- platelet-rich fibrin matrix). La preparación de trombina autóloga requiere tiempo y pasos adicionales, así como un mayor volumen de sangre; por otro lado, el uso de trombina bovina ha sido asociado con el desarrollo de anticuerpos contra los factores de coagulación V y XI, y la misma trombina, aumentando de esta forma el riesgo de anormalidades en la coagulación.<ref>Mazzucco L, Medici D, Serra M, Panizza R, Rivara G, Orecchia S, Libener R, Cattna E, Levis A, Betta PG, Borzini P. The use of autologous platelet gel to treat difficult to heal wounds: a pilot study. Transfusion 2004; 44: 1013-8.</ref><ref>Kevy SV, Jacobson MS. Comparison of methods for point of care preparation of autologous platelet gel. JECT 2004; 36: 28-35.</ref><ref>Bänninger H, Hardegger T, Tobler A, Barth A, Schüpbach P, Reinhart W, Lämmle B, Furlan M. Fibrin glue in surgery: frequent development of inhibitors of bovine thrombin and human factor V. Br J Haematol 1993; 85: 528-32.</ref> Adicionalmente, para asegurar una degranulación de plaquetas y la formación de un coágulo estable, se utilizan grandes cantidades de trombina, esto puede causar una liberación inmediata de los factores de crecimiento.<ref>Driver VR, Hanft J, Fylling CP, Beriou JM. Arospective, randomized, controlled trial of autologous platelet-rich plasma gel for the treatment of diabetic foot ulcers. Ostomy Wound Manage 2006;52:68-87.</ref> |
||
La liberación de factores de crecimiento es desencadenada por la activación de las plaquetas, esta puede ser iniciada por una gran variedad de sustancias o estímulos como la trombina, el cloruro de calcio, el colágeno o el adenosina 5c-difosfato.<ref>Sunitha R, Munirathnam N. Platelet-rich fibrin: Evolution of a second-generation platelet concentrate. Indian J Dent Res 2008; 19(1):42-46.</ref><ref>Marx RE, Carlson ER, Eichstaedt RM, Schimmele ST, Strauss JE, Georgeff KR. Platelet-rich plasma: Growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998;85:638-46.</ref> |
La liberación de factores de crecimiento es desencadenada por la activación de las plaquetas, esta puede ser iniciada por una gran variedad de sustancias o estímulos como la trombina, el cloruro de calcio, el colágeno o el adenosina 5c-difosfato.<ref>Sunitha R, Munirathnam N. Platelet-rich fibrin: Evolution of a second-generation platelet concentrate. Indian J Dent Res 2008; 19(1):42-46.</ref><ref>Marx RE, Carlson ER, Eichstaedt RM, Schimmele ST, Strauss JE, Georgeff KR. Platelet-rich plasma: Growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998;85:638-46.</ref> |
||
Revisión del 15:18 13 oct 2009
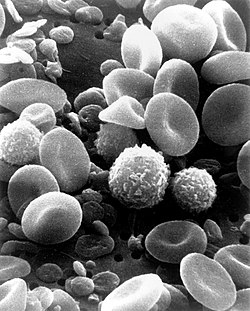
Los trombocitos o plaquetas son células, de unos 3 μm de diámetro, que se encuentran en la sangre y que se forman a partir de un tipo celular denominado megacariocito.
Son irregulares, sin núcleo ni otros orgánulos. Tienen una vida media de 7 a 10 días. Tienen gran importancia en la coagulación sanguínea por su capacidad para agregarse unas con otras en respuesta a diversos estímulos. Forman coágulos, gracias a que poseen gránulos de sustancias activadoras de la coagulación.
Después de los eritrocitos son los elementos celulares más abundantes de la sangre. Su cifra normal en Homo sapiens oscila entre 150 000 y 400 000 por mm³ (en España, por ejemplo, el valor medio es de 226 000 por microlitro con una desviación estándar de 46 000[1]). Se ven sólo en los mamíferos.
Tienen su origen en el tejido hematopoyético (formador de sangre) de la médula ósea, por fragmentación del citoplasma de unas células gigantes, las más grandes del tejido hematopoyético, llamadas megacariocitos.
Cumplen con un papel muy importante en la coagulación. Para ello forman nudos en la red fibrina, liberan substancias importantes para acelerar la coagulación y aumentan la retracción del coágulo sanguíneo.
También denominada trombocito, fragmento citoplasmático de un megacariocito (la célula de mayor tamaño presente en la médula ósea), que se encuentra en la sangre periférica, donde interviene en el proceso de coagulación de la sangre. Las plaquetas de la sangre son cuerpos pequeños, ovoideos, sin núcleo, con un diámetro mucho menor que el de los eritrocitos. Los trombocitos o plaquetas se adhieren a la superficie interna de la pared de los vasos sanguíneos en el lugar de la lesión y ocluyen el defecto de la pared vascular. Conforme se destruyen, liberan agentes coagulantes que conducen a la formación local de trombina que ayuda a formar un coágulo, el primer paso en la cicatrización de una herida.
Las plaquetas desempeñan un papel fundamental en la hemostasis y son una fuente natural de factores de crecimiento.[2] Liberan gran cantidad de factores de crecimiento, dentro de los cuales se tiene el factor de crecimiento derivado de plaquetas (PDGF del inglés- platelet-derived growth factor), un potente agente quimiotáctico, y el factor de crecimiento transformante-β1 (TGFβ1 del inglés- transforming growth factor-β1), que estimula la deposición de la matriz extracelular. Ambos de estos factores de crecimiento han mostrado jugar un papel importante en los procesos de reparación y regeneración de tejidos conectivos. Otros factores de crecmiento producidos por las plaquetas y asociados a los procesos curativos incluyen: factor de crecimiento básico del fibroblasto (basic fibroblast growth factor), factor de crecimiento-1 asociado a la insulina (IGF-1 del inglés- insulin-like growth factor-1), factor de crecimiento del epitelio (EGF del inglés- epithelial growth factor), factor de crecimiento del hepatocito (HGF del inglés- hepatocyte growth factor) y el factor de crecimiento del endotelio vascular (VEGF del inglés- vascular endothelial growth factor). La aplicación local de estos factores de crecimiento en altas concentraciones a través del plasma rico en plaquetas (PRP del inglés- platelet-rich plasma) ha sido utilizada, por varias décadas, para acelerar el proceso curativo de diferentes lesiones.[3][4][5][6][7][8][9]
Plasma Rico en Plaquetas (PRP)
La preparación del plasma rico en plaquetas (PRP) de gille puto, requiere la colección de sangre periférica del paciente, la separación de las plaquetas y el plasma de los otros elementos celulares sanguíneos, y la polimerización de la fibrina del plasma para concentrar las plaquetas en un gel-rico en plaquetas con suficiente estabilidad como para ser implantado quirúrgicamente. Actualmente, algunos métodos comerciales para la preparación del PRP utilizan calcio y trombina bovina[10][11] o bien, trombina preparada de forma autóloga para crear una matriz rica en plaquetas y fibrina (PRFM del inglés- platelet-rich fibrin matrix). La preparación de trombina autóloga requiere tiempo y pasos adicionales, así como un mayor volumen de sangre; por otro lado, el uso de trombina bovina ha sido asociado con el desarrollo de anticuerpos contra los factores de coagulación V y XI, y la misma trombina, aumentando de esta forma el riesgo de anormalidades en la coagulación.[12][13][14] Adicionalmente, para asegurar una degranulación de plaquetas y la formación de un coágulo estable, se utilizan grandes cantidades de trombina, esto puede causar una liberación inmediata de los factores de crecimiento.[15]
La liberación de factores de crecimiento es desencadenada por la activación de las plaquetas, esta puede ser iniciada por una gran variedad de sustancias o estímulos como la trombina, el cloruro de calcio, el colágeno o el adenosina 5c-difosfato.[16][17] Un coágulo sanguíneo de PRP contiene aproximadamente 4% de glóbulos rojos, 95% de plaquetas y 1% de glóbulos blancos. Las propiedades del PRP están basadas en los múltiples factores de crecimiento y de diferenciación producidos y liberados a raíz de la activación de las plaquetas. Estos factores son críticos para la regulación y estimulación del proceso curativo de lesiones. Por otro lado, existe una segunda generación del concentrado de plaquetas que recibe el nombre de matriz rica en plaquetas y fibrina (PRFM del inglés- platelet-rich fibrin matrix), la cual es un mejoramiento del PRP preparado tradicionalmente.[18]
Hay un método actual que evita el uso de trombina como activador[19] [20] .[21] Este sistema utiliza únicamente calcio y centrifugación para activar la polimerización de la fibrina y formar así el PRFM. PRFM, en forma de gel o una membrana densa y flexible, puede ser aplicada al paciente y la liberación de los factores de crecimiento es desencadenada por los activadores autólogos presentes en el sitio de aplicación. Este método permite una liberación gradual de los factores de crecimiento en el sitio de aplicación, que pueden emitir señales a diferentes tipos celulares para que emitan una respuesta en momentos apropiados. Estudios in-vitro indican que el PRFM presenta una liberación gradual y estable de los factores de crecimiento a lo largo de 7 días.[22]
El plasma rico en plaquetas (PRP) puede obtenerse por medio de diferentes técnicas ya sean separadores celulares de propósitos generales o bien, separadores celulares para la concentración de plaquetas.[23] Muchos productos comerciales se encuentran disponibles en este campo, la mayoría de ellos obtienen resultados similares, cuyas diferencias son concernientes al precio, tiempo, espacio requerido y la tecnología del aparato. Son pocos los productos comerciales disponibles para la obtención de una matriz rica en plaquetas y fibrina como producto final.
Referencias
- ↑ Agustino, AM., Piqueras, R., Pérez, M. et al. Recuento de plaquetas y volumen plaquetario medio en una población sana. Rev Diagn Biol. (online). abr.-jun. 2002, vol.51, no.2 (citado 23 julio de 2006), p.51-53. ISSN 0034-7973.
- ↑ Sunitha R, Munirathnam N. Platelet-rich fibrin: Evolution of a second-generation platelet concentrate. Indian J Dent Res 2008; 19(1):42-46
- ↑ O’Connell S, Impeduglia T, Hessler K, Wang XJ, Carroll R, Dardik H. Autologous platelet-rich fibrin matrix as cell therapy in the healing of chronic lower-extremity ulcers. Wound Rep Reg 2008; 16:749-756.
- ↑ Sánchez M, Anitua E, Azofra J, Andía I, Padilla S, Mujika I. Comparison of surgically repaired Achilles tendon tears using platelet-rich fibrin matrices. The American Journal of Sports Medicine 2007; 35 (2): 245-51.
- ↑ Knighton DR, Ciresi KF, Fiegel VD, Austin LL, Butler ELL. Classification and treatment of chronic nonhealing wounds: successful treatment with autologous platelet-derived wound healing factors (PDWHF). Ann surg 1986; 204:322-30.
- ↑ Knighton DR, Ciresi K, Fiegel VD, Schumerth S, Butler E, Cerra F. Stimulation of repair in chronic, non healing, cutaneous ulcers using platelet-derived wound healing formula. Surg Gynecol Obstet 1990; 170:56-60.
- ↑ Celotti F, Colciago A, Negri-Cesi P, Pravettoni A, Zaninetti R, Sacchi MC. Effect of platelet-rich plasma on migration and proliferation of SaOS-2 osteoblasts: role of platelet-derived growth factor and transforming growth factor-β. Wound Rep Regen 2006; 14:195-202.
- ↑ McAleer JP, Sharma S, Kaplan EM, Perisch G. Use of autologous platelet concentrate in a nonhealing lower extremity wound. Adv Skin Wound Care 2006; 19:354-63.
- ↑ Driver VR, Hanft J, Fylling CP, Beriou JM. Arospective, randomized, controlled trial of autologous platelet-rich plasma gel for the treatment of diabetic foot ulcers. Ostomy Wound Manage 2006;52:68-87.
- ↑ McAleer JP, Sharma S, Kaplan EM, Perisch G. Use of autologous platelet concentrate in a nonhealing lower extremity wound. Adv Skin Wound Care 2006; 19:354-63.
- ↑ Driver VR, Hanft J, Fylling CP, Beriou JM. Arospective, randomized, controlled trial of autologous platelet-rich plasma gel for the treatment of diabetic foot ulcers. Ostomy Wound Manage 2006;52:68-87.
- ↑ Mazzucco L, Medici D, Serra M, Panizza R, Rivara G, Orecchia S, Libener R, Cattna E, Levis A, Betta PG, Borzini P. The use of autologous platelet gel to treat difficult to heal wounds: a pilot study. Transfusion 2004; 44: 1013-8.
- ↑ Kevy SV, Jacobson MS. Comparison of methods for point of care preparation of autologous platelet gel. JECT 2004; 36: 28-35.
- ↑ Bänninger H, Hardegger T, Tobler A, Barth A, Schüpbach P, Reinhart W, Lämmle B, Furlan M. Fibrin glue in surgery: frequent development of inhibitors of bovine thrombin and human factor V. Br J Haematol 1993; 85: 528-32.
- ↑ Driver VR, Hanft J, Fylling CP, Beriou JM. Arospective, randomized, controlled trial of autologous platelet-rich plasma gel for the treatment of diabetic foot ulcers. Ostomy Wound Manage 2006;52:68-87.
- ↑ Sunitha R, Munirathnam N. Platelet-rich fibrin: Evolution of a second-generation platelet concentrate. Indian J Dent Res 2008; 19(1):42-46.
- ↑ Marx RE, Carlson ER, Eichstaedt RM, Schimmele ST, Strauss JE, Georgeff KR. Platelet-rich plasma: Growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998;85:638-46.
- ↑ Sunitha R, Munirathnam N. Platelet-rich fibrin: Evolution of a second-generation platelet concentrate. Indian J Dent Res 2008; 19(1):42-46.
- ↑ Ortel TL, Mercer MC, Thames EH, Moore KD, Lawson JH. Immunologic impact and clinical outcomes after surgical exposure to bovine thrombin. Ann Surg 2001; 233: 88-96.
- ↑ Schoenecker JG, Johnson RK, Lesher AP, Day JD, Love SD, Hoffman MR, Ortel TL, Parker W, Lawson JH. Exposure of mice to topical bovine thrombin induces systemic autoimmunity. Am J Pathol 2001; 159: 1957-69.
- ↑ Vercellino V, Carbone V, Griffa A. The use of autologous materials for treatment of large maxillary cysts: filling of the residual post-cystectomy cavity. 5th Congress, Society Odontostonatologica Italiano, Turin, Italy, December 1, 2000.
- ↑ Gosch C, Zeichner A, Carroll R, Bois J. Evaluation of an autologous platelet rich fibrin matrix technology for diabetic foot ulcer treatment. Wound Rep Regen 2007; 15: A38.
- ↑ Sunitha R, Munirathnam N. Platelet-rich fibrin: Evolution of a second-generation platelet concentrate. Indian J Dent Res 2008; 19(1):42-46.
