Diferencia entre revisiones de «Polaridad (química)»
Apariencia
Contenido eliminado Contenido añadido
m Revertidos los cambios de 201.239.156.8 a la última edición de Veon usando Huggle |
Sin resumen de edición |
||
| Línea 3: | Línea 3: | ||
Una sustancia es polar cuando sus moléculas se reordenan ante la presencia de un campo eléctrico. Aquellas sustancias en las que este fenómeno no sucede se denominan "no polares" o "apolares". |
Una sustancia es polar cuando sus moléculas se reordenan ante la presencia de un campo eléctrico. Aquellas sustancias en las que este fenómeno no sucede se denominan "no polares" o "apolares". |
||
Es '''polar''' aquella [[molécula]] en la que la distribución de las [[carga eléctrica|cargas eléctricas]] no es simétrica respecto a un centro. El carácter dipolar de ciertas moléculas depende de la presencia de enlaces polares en su estructura, aunque pueden existir moléculas con enlaces polares pero que sin embargo no tengan momento dipolar neto debido a una distribución simétrica de las cargas, caso del [[metano]]. Es necesaria cierta asimetría para que los componentes de los momentos dipolares generadas en cada uno de los enlaces polares no se cancelen y por ende exista polaridad. El carácter polar de una molécula, es medido por el [[momento dipolar]], el cual es igual a la suma de cada uno de los momentos dipolares originados en cada uno de los enlaces polares de la molécula. |
|||
Las moléculas polares se disuelven fácilmente en disolventes polares y no lo hacen sin embargo en disolventes no polares. El disolvente polar por excelencia es el agua, así que las sustancias polares son hidrosolubles o hidrófilas, mientras las no polares son hidrófobas. |
|||
La polaridad eléctrica es un factor esencial de la organización de las moléculas biológicas en estructuras supramoleculares, como las membranas de bicapa, estructuradas por moléculas de [[lípidos]] que tienen una parte polar y otra no polar (moléculas [[anfipática]]s). |
|||
[[Categoría:Enlaces químicos]] |
|||
[[Categoría:Fisicoquímica]] |
|||
[[Categoría:Propiedades químicas]] |
|||
[[en:Chemical polarity]] |
|||
[[fr:Molécule polaire]] |
|||
[[he:קוטביות]] |
|||
[[ja:極性分子]] |
|||
[[nl:Polaire verbinding]] |
|||
[[pt:Molécula polar]] |
|||
[[sv:Polär]] |
|||
Revisión del 21:44 2 abr 2009
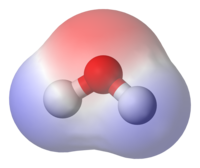
Una sustancia es polar cuando sus moléculas se reordenan ante la presencia de un campo eléctrico. Aquellas sustancias en las que este fenómeno no sucede se denominan "no polares" o "apolares".
