Diferencia entre revisiones de «Siloxano»
Artículo creado con el #Asistentedeartículos Etiquetas: sin categorizar editor de código 2017 |
(Sin diferencias)
|
Revisión del 09:21 29 mar 2020
Un siloxano es un grupo funcional en química de organosilicio con el enlace Si – O – Si.

Los siloxanos originales incluyen los hidruros oligoméricos y poliméricos con las fórmulas H (OSiH2) nOH y (OSiH2) n. [1] Los siloxanos también incluyen compuestos ramificados, cuya característica definitoria es que cada par de centros de silicio está separado por un átomo de oxígeno. El grupo funcional siloxano forma la columna vertebral de las siliconas, cuyo principal ejemplo es el polidimetilsiloxano. [2] El grupo funcional R3SiO- (donde las tres R pueden ser diferentes) se llama siloxi. Los siloxanos son artificiales y tienen muchas aplicaciones comerciales e industriales debido a la hidrofobicidad de los compuestos, su baja conductividad térmica y su alta flexibilidad. [3]
Estructura
Los siloxanos generalmente adoptan estructuras esperadas para los centros tetraédricos unidos ("tipo sp3"). El enlace Si – O es 1.64 Å (vs distancia Si – C de 1.92 Å) y el ángulo Si – O – Si es bastante abierto a 142.5 °. [4] Por el contrario, la distancia C – O en un dialquil éter típico es mucho más corta a 1.414 (2) Å con un ángulo C – O – C más agudo de 111 °. [5] Se puede apreciar que los siloxanos tendrían bajas barreras para la rotación alrededor de los enlaces Si-O como consecuencia de un bajo impedimento estérico. Esta consideración geométrica es la base de las propiedades útiles de algunos materiales que contienen siloxano, como sus bajas temperaturas de transición vítrea.
Nomenclature
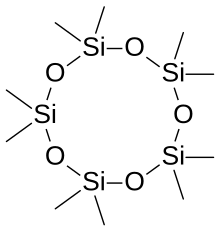
La palabra siloxano se deriva de las palabras silicio, oxígeno y alcano. En algunos casos, los materiales de siloxano se componen de varios tipos diferentes de grupos de siloxano; estos están etiquetados de acuerdo con el número de enlaces Si-O. M-units: (CH3)3SiO0.5, D-units: (CH3)2SiO, T-units: (CH3)SiO1.5
| Cyclic siloxanes (cyclomethicones) | CAS | Linear siloxanes | CAS |
|---|---|---|---|
| L2, MM: hexamethyldisiloxane | 107-46-0 | ||
| D3: hexamethylcyclotrisiloxane | 541-05-9 | L3, MDM: octamethyltrisiloxane | 107-51-7 |
| D4: octamethylcyclotetrasiloxane | 556-67-2 | L4, MD2M: decamethyltetrasiloxane | 141-62-8 |
| D5: decamethylcyclopentasiloxane | 541-02-6 | L5, MD3M: dodecamethylpentasiloxane | 141-63-9 |
| D6: dodecamethylcyclohexasiloxane | 540-97-6 | L6, MD4M: tetradecamethylhexasiloxane | 107-52-8 |
Synthesis of siloxanes

The main route to siloxane functional group is by hydrolysis of silicon chlorides:
- 2 R3Si–Cl + H2O → R3Si–O–SiR3 + 2 HCl
The reaction proceeds via the initial formation of silanols (R3Si–OH):
- R3Si–Cl + H2O → R3Si–OH + HCl
The siloxane bond can then form via a silanol + silanol pathway or a silanol + chlorosilane pathway:
- 2 R3Si–OH → R3Si–O–SiR3 + H2O
- R3Si–OH + R3Si–Cl → R3Si–O–SiR3 + HCl
Hydrolysis of a silyldichloride can afford linear or cyclic products. Linear products are terminated with silanol groups:
- n R2Si(OH)2 → H(R2SiO)nOH + (n−1) H2O
Cyclic products have no silanol termini:
- n R2Si(OH)2 → (R2SiO)n + n H2O
The linear products, polydimethylsiloxane (PDMS), are of great commercial value. Their production requires the production of dimethylsilicon dichloride.
Starting from trisilanols, cages are possible, such as the species with the formula (RSi)nO3n/2 with cubic (n = 8) and hexagonal prismatic (n = 12). (RSi)8O12 structures. The cubic cages are cubane-type clusters, with silicon centers at the corners of a cube oxygen centres spanning each of the twelve edges.[2]
Reactions
Oxidation of organosilicon compounds, including siloxanes, gives silicon dioxide. This conversion is illustrated by the combustion of hexamethylcyclotrisiloxane:
- ((CH3)2SiO)3 + 12 O2 → 3 SiO2 + 6 CO2 + 9 H2O
Strong base degrades siloxane group, often affording siloxide salts:
- ((CH3)3Si)2O + 2 NaOH → 2 (CH3)3SiONa + H2O
This reaction proceeds by production of silanols. Similar reactions are used industrially to convert cyclic siloxanes to linear polymers.[3]
- ↑ Silicon: Organosilicon Chemistry. Encyclopedia of Inorganic Chemistry Online, 2nd ed.; Wiley: New Jersey, 2005. doi 10.1002/0470862106.ia220
- ↑ S. D. Kinrade, J. C. H. Donovan, A. S. Schach and C. T. G. Knight (2002), Two substituted cubic octameric silicate cages in aqueous solution. J. Chem. Soc., Dalton Trans., 1250 - 1252. doi 10.1039/b107758a
- ↑ Röshe, L.; John, P.; Reitmeier, R. "Organic Silicon Compounds" Ullmann’s Encyclopedia of Industrial Chemistry. John Wiley and Sons: San Francisco, 2003. doi 10.1002/14356007.a24_021.
