Diferencia entre revisiones de «Hidrólisis»
Contenido eliminado Contenido añadido
Sin resumen de edición |
m Revertidos los cambios de 201.206.12.190 a la última edición de Andreasmperu |
||
| Línea 1: | Línea 1: | ||
[[Imagen:Ester hydrolysis.png|thumb|right|300px|Hidrólisis de [[éster]]es.]] |
[[Imagen:Ester hydrolysis.png|thumb|right|300px|Hidrólisis de [[éster]]es.]] |
||
La '''hidrólisis''' es una [[reacción química]] entre [[agua]] y otra [[sustancia]], como [[Sal (química)|sal]]es. Al ser disueltas en agua, sus iones constituyentes se combinan con los iones [[hidronio]] u [[oxonio]], H<sub>3</sub>O<sup>+</sup> o bien con los iones [[hidroxilo]], OH<sup>-</sup>, o ambos. Dichos iones proceden de la disociación o [[autoprotólisis]] del agua. Esto produce un desplazamiento del [[equilibrio químico|equilibrio]] de disociación del agua y |
La '''hidrólisis''' es una [[reacción química]] entre [[agua]] y otra [[sustancia]], como [[Sal (química)|sal]]es. Al ser disueltas en agua, sus iones constituyentes se combinan con los iones [[hidronio]] u [[oxonio]], H<sub>3</sub>O<sup>+</sup> o bien con los iones [[hidroxilo]], OH<sup>-</sup>, o ambos. Dichos iones proceden de la disociación o [[autoprotólisis]] del agua. Esto produce un desplazamiento del [[equilibrio químico|equilibrio]] de disociación del agua y como consecuencia se modifica el valor del [[pH]]. |
||
Las sales de los [[ácido]]s débiles o [[base]]s débiles se hidrolizan por acción del agua, dependiendo, el grado de la reacción, de la debilidad del ácido o la base. Es decir, cuanto más débil sea el ácido o la base, mayor es la hidrólisis. |
Las sales de los [[ácido]]s débiles o [[base]]s débiles se hidrolizan por acción del agua, dependiendo, el grado de la reacción, de la debilidad del ácido o la base. Es decir, cuanto más débil sea el ácido o la base, mayor es la hidrólisis. |
||
Revisión del 19:12 13 oct 2009
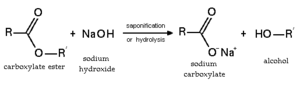
La hidrólisis es una reacción química entre agua y otra sustancia, como sales. Al ser disueltas en agua, sus iones constituyentes se combinan con los iones hidronio u oxonio, H3O+ o bien con los iones hidroxilo, OH-, o ambos. Dichos iones proceden de la disociación o autoprotólisis del agua. Esto produce un desplazamiento del equilibrio de disociación del agua y como consecuencia se modifica el valor del pH.
Las sales de los ácidos débiles o bases débiles se hidrolizan por acción del agua, dependiendo, el grado de la reacción, de la debilidad del ácido o la base. Es decir, cuanto más débil sea el ácido o la base, mayor es la hidrólisis.
