Diagramas de Tanabe Sugano

Los diagramas de Tanabe-Sugano son usados en la química de coordinación para predecir las absorciones en el UV-Visible e IR de compuestos de coordinación. Estos diagramas permiten hacer un cálculo aproximado de la energía de desdoblamiento del campo ligando (10dq o Δo) que puede ser comparada con los resultados experimentales. Estos diagramas funcionan tanto para complejos de alto espín como de bajo espín, a diferencia de los diagramas de Orgel que solo funcionan para complejos de alto espín.
Historia[editar]
Cuando Yukito Tanabe y Satoru Sugano publicaron su artículo sobre los espectros de absorción de complejos iónicos, había poca información sobre los estados electrónicos de complejos metálicos. Ellos usaron la teoría de campo cristalino de Hans Bethe y las combinaciones lineales de Giulio Racah,[1] para determinar los ahora llamados parámetros de Racah que servían para explicar los espectros de absorción de compuestos octaédricos de una mejor manera que la existente.[2] Estimaron los valores de los parámetros de Racah B y C, para cada configuración electrónica basada en los espectros absorción de los metales del primer grupo (metales Alcalinos). Las gráficas de las energías calculadas para cada estado de transición son conocidas como los diagramas de Tanabe-Sugano.[3][4]
Parámetros[editar]
Dado que estos diagramas consideran la correlación que existe entre los estados de alto y bajo espín, es necesario incluir todos los estados del sistema. Además para hacerlos generales habremos de incluir algunos otros parámetros. Tomando en cuenta que la repulsión electrónica es la responsable de las diferencias energéticas entre los estados espectroscópicos, es necesario expresarla por medio de algunos parámetros que hablen de ella, estos no son más que combinaciones lineales de algunas integrales de Coulomb y de intercambio, y se les conoce como los parámetros de Racah B y C. Estos, a pesar de poder obtenerse numéricamente, en general se evalúan empíricamente a partir de los espectros de los iones libre. A continuación se presentan una tabla con los valores de B y C para un grupo de metales de transición.[5]
| Carga → | 0 | 0 | +1 | +1 | +2 | +2 | +3 | +3 | +4 | +4 |
|---|---|---|---|---|---|---|---|---|---|---|
| Elemento ↓ | B | B/C | B | B/C | B | B/C | B | B/C | B | B/C |
| Ti | 560 | 3.3 | 680 | 3.7 | 720 | 3.7 | ||||
| V | 580 | 3.9 | 660 | 4.2 | 765 | 3.9 | 860 | 4.8 | ||
| Cr | 790 | 3.2 | 710 | 3.9 | 830 | 4.1 | 917 | 4.5 | 1040 | 4.1 |
| Mo | 460 | 3.9 | 440 | 4.5 | ||||||
| W | 370 | 5.1 | ||||||||
| Mn | 720 | 4.3 | 870 | 3.8 | 860 | 3.5 | 680 | |||
| Re | 850 | 3.4 | 470 | 4.0 | 1140 | 3.2 | ||||
| Fe | 805 | 4.4 | 870 | 4.2 | 1060 | 4.1 | ||||
| Ru | 600 | 5.4 | 670 | 3.5 | 620 | 6.5 | ||||
| Co | 780 | 5.3 | 880 | 4.4 | 1120 | 3.9 | ||||
| Ni | 1025 | 4.1 | 1040 | 4.2 | 1080 | 4.5 | ||||
| Pd | 830 | 3.2 | ||||||||
| Cu | 1220 | 4.0 | 1240 | 3.8 |
Para obtener las diferencias de energía entre los estados de diferente multiplicidad, se requieren ambos parámetros B y C (por ejemplo, la diferencia entre las energías entre el 4F y el 2G es 4B+ 3C) y para caracterizar los estados de la misma multiplicidad, el parámetro B basta. Entonces los diagramas de Tanabe-Sugano se presentan como gráficas de la energía de separación en términos de 10dq, pero expresados en unidades de E/B y 10dq/B respectivamente.[6]
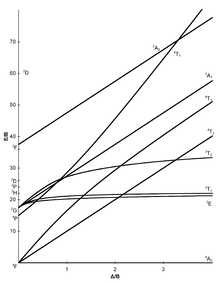
En los diagramas de Tanabe-Sugano, el estado de mínima energía es el eje X, este eje expresado en términos del parámetro de desdoblamiento del campo ligando ( 10dq o Δo) dividido entre el parámetro de Racah (B). consecuentemente, la distancia vertical sobre el eje es una medida de la energía sobre el estado basal. Por ejemplo, en un sistema d2, el estado de mínima energía es descrito por la línea en el diagrama de correlación uniendo el estado 3T1g del término 3F con el 3T1g del término t2g2. En el diagrama de Tanabe-Sugano (figura abajo), esta línea es horizontal y se etiqueta como 3T1g(F), surgiendo del término 3F en el límite de ion libre (la F entre paréntesis distingue este término 3T1g del término de mayor energía 3T1g que surge del término 3P).[7]
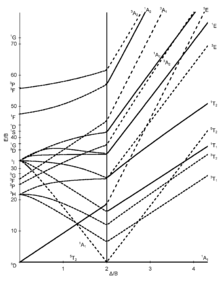
El eje Y está expresado en términos de la energía del estado excitado dividido sobre el parámetro de Racah (E/B), los estados de misma multiplicidad de espín que el estado basal están representados por cada una de las bandas transversales en los diagramas, (son las transiciones posibles por espín) los estados excitados de otra multiplicidad se muestran pero por lo regular no son importantes en la interpretación y esto se debe a que las Transiciones a estados excitados de misma multiplicidad son más probables que de distinta multiplicidad. Para enfatizarlo, En algunos se muestra el estado basal y los estados excitados de misma multiplicidad que el basal se muestran como líneas gruesas, mientras que estados con multiplicidades distintas, se muestran como líneas punteadas. A continuación se muestra las representaciones irreducibles de cada término.[7]
| Término | Degeneración | estados |
|---|---|---|
| S | 1 | A1g |
| P | 3 | T1g |
| D | 5 | Eg + T2g |
| F | 7 | A2g + T1g + T2g |
| G | 9 | A1g + Eg + T1g + T2g |
| H | 11 | Eg + T1g + T1g + T2g |
| I | 13 | A1g + A2g + Eg + T1g + T2g + T2g |
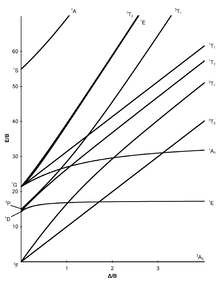
Diagramas de Tanabe-Sugano[editar]
Diagramas innecesarios: d1, d9 y d10[editar]

d1[editar]
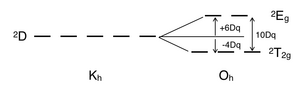
No hay repulsión de electrones en un complejo d1, y el único electrón reside en el estado fundamental t2g. Un complejo metálico octaédrico d1, como [Ti(H2O)6]3+, muestra una sola banda de absorción en un experimento UV-vis.[8] El símbolo de término para d1 es 2D, que se divide en los estados 2T2g y 2Eg. El conjunto orbital t2g contiene el único electrón y tiene una energía de estado 2T2g de -4Dq. Cuando ese electrón es promovido a una órbita eg, se excita a la energía de estado 2Eg, +6Dq. Esto está de acuerdo con la banda de absorción única en un experimento UV-vis. El hombro prominente en esta banda de absorción se debe a una distorsión Jahn-Teller que elimina la degeneración de los dos estados 2Eg. Sin embargo, dado que estas dos transiciones se solapan en un espectro UV-vis, esta transición de 2T2g a 2Eg no requiere un diagrama Tanabe-Sugano.[9]
d9[editar]
Similar a los complejos metálicos de d1, los complejos metálicos octaédricos d9 tienen un término espectral 2D. La transición es desde la configuración (t2g)6(eg)3 (estado (2Eg) a la configuración t2g)5(eg)4 (estado (2T2g) Esto también podría describirse como un "agujero" positivo que se mueve desde el conjunto orbital eg hasta el conjunto orbital t2g. El signo de Dq es opuesto al de d1, con un estado fundamental 2Eg un estado de excitación de 2T2g. Al igual que el caso d1, los complejos octaédricos d9 no requieren el diagrama Tanabe-Sugano para predecir sus espectros de absorción.
d10[editar]
No hay transiciones de electrones d-d en los complejos metálicos d10 porque las órbitas d están completamente llenas. Por lo tanto, no se observan bandas de absorción UV-vis absorción y no existe un diagrama Tanabe-Sugano.
Diagramas de simetría tetraédrica[editar]
Los diagramas Tetraédricos Tanabe-Sugano generalmente no se encuentran en los libros de texto porque el diagrama para un dn tetraédrico será similar al de un d(10-n) octaédrico, recordando que ΔT para los complejos tetraédricos es aproximadamente 4/9 de ΔO para un complejo octaédrico. Una consecuencia del tamaño mucho menor de ΔT hace que (casi) todos los complejos tetraédricos tengan un alto spin y por lo tanto el cambio en el término del estado basal visto en el eje X para los diagramas octaédricos d4-d7 no es necesario para interpretar los espectros de los complejos tetraédricos.
Ventajas sobre los diagramas de Orgel[editar]
En los diagramas de Orgel, la magnitud de la energía de división ejercida por los ligandos en los orbitales d, como aproximación iónica libre a un campo de ligandos, se compara con la energía de repulsión de electrones, que son suficientes para proporcionar la colocación de los electrones. Sin embargo, si la energía de división del campo de ligandos, 10Dq, es mayor que la energía de repulsión de electrones, entonces los diagramas de Orgel fallan al determinar la colocación de los electrones. En este caso, los diagramas de Orgel están restringidos sólo a los complejos de espín alto.[10]
Los diagramas Tanabe-Sugano no tienen esta restricción, y pueden aplicarse a situaciones en las que 10Dq es significativamente mayor que la repulsión de electrones. Así, los diagramas Tanabe-Sugano se utilizan para determinar la colocación de los electrones en complejos metálicos de alto y bajo spin. Sin embargo, son limitados en el sentido de que sólo tienen un significado cualitativo. Aun así, los diagramas Tanabe-Sugano son útiles para interpretar los espectros UV y determinar el valor de 10Dq.[10]
Aplicaciones como herramienta cualitativa[editar]
En un campo de ligandos centrosimétricos, como en los complejos octaédricos de metales de transición, la disposición de los electrones en el orbital d no sólo está limitada por la energía de repulsión de los electrones, sino que también está relacionada con la división de los orbitales debido al campo de ligandos. Esto conduce a muchos más estados de configuración de los electrones que en el caso del ion libre. La energía relativa de la energía de repulsión y la energía de división define los Estados de rotación alta y baja.
Considerando tanto los campos de ligandos débiles como los fuertes, un diagrama Tanabe-Sugano muestra la división de energía de los términos espectrales con el aumento de la intensidad del campo de ligandos. Es posible que entendamos cómo se distribuye la energía de los diferentes estados de configuración a ciertas concentraciones de ligandos. La restricción de la regla de selección de efectos facilita aún más la predicción de las posibles transiciones y su intensidad relativa. Aunque son cualitativos, los diagramas Tanabe-Sugano son herramientas muy útiles para el análisis de espectros UV: se utilizan para asignar bandas y calcular valores Dq para la división de campos de ligandos.[11][12]
Ejemplos[editar]

Manganeso(II) hexahidrato[editar]
En el complejo metálico [Mn(H2O)6]2+, el manganeso tiene un estado de oxidación de +2, por lo que es un ion d5. H2O es un ligando de campo débil (el espectro se muestra a continuación), y según el diagrama Tanabe-Sugano para los iones d5, el estado de la tierra es 6A1. Tenga en cuenta que no hay multiplicidad de espín de sexteto en ningún estado de excitación, por lo tanto, se espera que las transiciones desde este estado de tierra sean prohibidas con espín y las intensidades de la banda deben ser bajas. A partir de los espectros, sólo se observan bandas de muy baja intensidad (valores de absorción molar bajos (ε) en el eje y).[11]
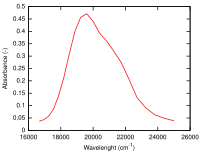
.
Cobalto(II) hexahidrato[editar]
Otro ejemplo es [Co(H2O)6]2+.[12] Tenga en cuenta que el ligando es el mismo que en el último ejemplo. Aquí el ion cobalto tiene el estado de oxidación de +2, y es un ion d7. Desde el lado de alta rotación (izquierda) del diagrama d7 Tanabe-Sugano, el estado del suelo es 4T1(F), y la multiplicidad de espín es un cuarteto. El diagrama muestra que hay tres estados excitados por el cuarteto: 4T2, 4A2, y 4T1(P). Del diagrama se puede predecir que hay tres transiciones permitidas de espín. Sin embargo, el espectro de [Co(H2O)6]2+ no muestra tres picos distintos que corresponden a los tres estados de excitación previstos. En cambio, el espectro tiene un pico amplio (el espectro se muestra a continuación). Basado en el diagrama T-S, la transición de energía más baja es 4T1 a 4T2, que se ve en el IR cercano y no se observa en el espectro visible. El pico principal es la transición de energía 4T1(F) a 4T1(P), y se prevé que la transición de energía ligeramente superior (el hombro) sea 4T1 a 4A2. La pequeña diferencia de energía conduce a la superposición de los dos picos, lo que explica el amplio pico observado en el espectro visible.
Solución para B y ΔO[editar]
El espectro de absorción puede usarse para determinar la magnitud de Δo para complejos octaédricos. La precisión estará limitada por las herramientas matemáticas empleadas en la resolución del problema. Los espectros de absorción tienen frecuentemente bandas sobrepuestas, lo que requiere de una técnica matemática (desconvolución) adecuada para reducir las bandas sobrepuestas en sus componentes individuales. Podemos obtener Δo y a veces el parámetro de Racah con precisión simplemente usando las posiciones de los máximos de absorción tomados directamente del espectro.
La facilidad con que se puede determinar Δo depende de la configuración dn del metal; en algunos casos, Δo puede leerse fácilmente del espectro, en otros un análisis más complicado es necesario.
Diagramas d1, d4 (hs), d6 (hs), d9[editar]
En cada caso hay un estado excitado de misma multiplicidad de spin que el estado basal. Por tanto, hay solo una absorción permitida por spin, con la energía de la radiación absorbida igual a Δo.
Diagramas d3, d8[editar]
Estas configuraciones tienen un término de estado basal F. En un campo octaédrico, el término F se divide en tres términos: A2g, T2g y T1g. A2 es el término de menor energía para d3 o d8. Para estas configuraciones, la diferencia en energía entre los dos términos de menor energía es Δo (es decir la transición 4A2 →4T2 para un d3 y un d8 3A2 →3T2 . Por tanto, para encontrar Δo simplemente encontramos la energía de la transición de mínima energía en el espectro de absorción.
Diagramas d2, d7 (hs)[editar]
Uno querría simplemente tomar el valor de la transición 3T1g → 3T2g y asignarla a Δo (después de todo, 3T1g (F) es t2g y 3T2g es eg, y la diferencia DEBERÍA ser Δo). Sin embargo, debido a que el mezclado de 3T1g(F) y 3T1g(P) causa una curvatura en ambas líneas, llevaría a un error si empleáramos el estado basal para obtener Δo.

Para obtener un valor más exacto es necesario calcular el parámetro de Racah B, el primer paso es calcular la relación que hay entre las dos absorciones que aparecen en el espectro UV-Visible (V2 / V1 el cual debe ser mayor a 1), el segundo paso es encontrar la posición en el eje X de diagrama de Tanabe-Sugano donde la relación entre la distancia que hay entre la línea del estado basal a 3T1g y del estado basal a 3T2g (para un d2) sea igual a la relación V2 / V1. A continuación se muestra una tabla que se puede utilizar para hacer este cálculo para un d2 .[13]
| Δo/ B | V1(cm) | V2(cm) | V2 / V1 |
|---|---|---|---|
| 5 | 0.5 | 1 | 2 |
| 10 | 1.1 | 2 | 1.82 |
| 15 | 1.6 | 2.7 | 1.67 |
| 20 | 2.2 | 3.6 | 1.64 |
| 25 | 2.9 | 4.4 | 1.52 |
| 30 | 3.5 | 4.9 | 1.40 |
| 35 | 4 | 5.5 | 1.38 |
| 40 | 4.6 | 6 | 1.30 |
Una vez que se analizó que en parte de Δo / B se encuentra esta relación lo siguiente es sustituir los valores correspondientes del eje Y en la expresión Y= E / B donde E es el valor de la absorción de V2 y V1 y así poder calcular el parámetro de Racah B como un promedio de los dos valores obtenidos.
Diagramas d5 (hs), d4 - d7 (ls)[editar]
d5 (hs) no tiene estados excitados de la misma multiplicidad. Las bandas de absorción son transiciones prohibidas por spin y son débiles. . Para configuraciones d4 – d7 (ls) el análisis es difícil ya que hay muchos estados excitados de misma multiplicidad que el estado basal.
Véase también[editar]
Referencias[editar]
- ↑ Racha, Giulio. «Theory of complex spectra II». Physical Review. Bibcode:1942PhRv...62..438R. doi:10.1103/PhysRev.62.438.
- ↑ Tanabe, Yukito; Sugano, Satoru (1954). «On the absorption spectra of complex ions I». Journal of the Physical Society of Japan. doi:10.1143/JPSJ.9.753.
- ↑ Tanabe, Yukito; Sugano, Satoru (1954). «On the absorption spectra of complex ions II». Journal of the Physical Society of Japan. doi:10.1143/JPSJ.9.766.
- ↑ Tanabe, Yukito; Sugano, Satoru (1956). «On the absorption spectra of complex ions III». Journal of the Physical Society of Japan. doi:10.1143/JPSJ.11.864.
- ↑ Cotton, F. Albert; Wilkinson, Geoffrey (1962). Advanced Inorganic Chemistry (en inglés). John Wiley and Sons Inc. ISBN 0-471-17560-9. (requiere registro).
- ↑ Profesor Ricardo Rafael Contreras. «Diagrama de Tanabe Sugano». Archivado desde el original el 8 de diciembre de 2015. Consultado el 17 de noviembre de 2015.
- ↑ a b Miseree, Gary L.; Fischer, Paul J.; Tara, Donal A. (2014). «11». Inorganic Chemistry (en inglés). New Yrok: Pearson Education. ISBN 978-0-321-81105-9.
- ↑ Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasShriver06 - ↑ «Espectroscopia electrónica». Purcell & Kotz. Ed. Reverté (1979) Barcelona. 15 de noviembre de 2015. Archivado desde el original el 8 de diciembre de 2015. Consultado el 15 de noviembre de 2015.
- ↑ a b Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasDMA - ↑ a b Jørgensen, Chr Klixbüll; De Verdier, Carl-Henric; Glomset, John; Sörensen, Nils Andreas (1954). «Studies of absorption spectra IV: Some new transition group bands of low intensity». Acta Chem. Scand. 8 (9): 1502-1512. doi:10.3891/acta.chem.scand.08-1502.
- ↑ a b Jørgensen, Chr Klixbüll; De Verdier, Carl-Henric; Glomset, John; Sörensen, Nils Andreas (1954). «Studies of absorption spectra III: Absoprtion Bands as Gaussian Error Curves». Acta Chem. Scand. 8 (9): 1495-1501. doi:10.3891/acta.chem.scand.08-1495.
- ↑ UCDAVIS. «Tanabe-Sugano Diagrams» (en iNGLés). Consultado el 20 de noviembre de 2015.