Vanadato

En química, un vanadato es un compuesto que contiene un oxianión de vanadio en su estado de oxidación más alto, +5. El ion vanadato más simple es el anión ortovanadato VO43−, tetraedro, el cual está presente, por ejemplo, en el ortovanadato de sodio y en soluciones de V2O5 en una base fuerte (pH > 13[1]). Convencionalmente este ion es representado con un enlace doble sencillo, sin embargo esta es una forma de resonancia ya que el ion es un tetraedro regular con cuatro átomos de oxígeno equivalentes.
Ejemplos de iones vanadato
Algunos ejemplos de iones discretos son
- VO43− "ortovanadato", tetrahedral.[2]
- V2O74− "pirovanadato", ángulo compartido VO4 tetrahedra similar to dichromate ion[2]
- V3O93− cíclico con ángulo compartido VO4 tetrahedra[3]
- V4O124− cyclic with corner shared VO4 tetrahedra[4]
- V5O143− corner shared VO4 tetrahedra[5]
- V10O286− "decavanadate", edge and corner shared VO6 octahedra[2]
- V12O324−[2]
- V13O343− Octahedro VO6 fundido[6]
- V18O4212−[7]
Algunos ejemplos de iones poliméricos "infinitos" son
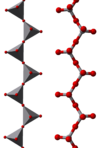 |
 |
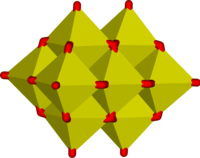 |
Química analítica de los metavanadatos[9]
Para el estudio de estas reacciones se utiliza una disolución 0.1 M de metavanadato de amonio (NH4VO3) o de sodio (NaVO3). Agregar una pequeña cantidad de ácido sulfúrico mantiene estable esas disoluciones.
1. Sulfuro de hidrógeno: No se produce precipitado en disolución ácida pero se forma una disolución azul debido a la producción de iones tetravalentes y azufre. Otros agentes reductores, tales como el dióxido de azufre, ácido oxálico, sulfato de hierro (II), hidrazina, ácido fórmico y etanol dan iones de vanadio (IV) azul. La reacción ocurre lentamente en frío pero más rápidamente por calentamiento.
2. Zinc, cadmio o aluminio en disolución ácida. Estos son aún más reductores. La disolución se torna primero azul (iones dioxovanadio VO2+) luego verdes (V+3) y finalmente violeta (V+2).
3. Disolución de sulfuro de amonio. La disolución se torna color rojo claro debido a la formación de tiovanadatos. Por acidificación de la disolución se precipita incompletamente el sulfuro de vanadio marrón V2S5. El precipitado es soluble en disoluciones alcalinas, carbonatos y sulfuros.
4. Peróxido de hidrógeno. Cuando se agregan gota a gota una disolución de peróxido de hidrógeno a una disolución ácida (15-20% de ácido sulfúrico) de un vanadato, se produce una coloración roja debido a la formación del catión peroxivanadilo (V), VO2+3 :
VO3- + 4H+ + H2O2 → VO2+3 + 3H2O
Referencias
- ↑ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ↑ a b c d e Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBN 0-08-037941-9
- ↑ Hamilton E. E., Fanwick P.E., Wilker J.J. (2002). «The Elusive Vanadate (V3O9)3−: Isolation, Crystal Structure, and Nonaqueous Solution Behavior». J. Am. Chem. Soc. 124 (1): 78. doi:10.1021/ja010820r.
- ↑ G.-Y. Yang, D.-W. Gao, Y. Chen, J.-Q. Xu, Q.-X. Zeng, H.-R. Sun, Z.-W. Pei, Q. Su, Y. Xing, Y.-H. Ling and H.-Q. Jia (1998). «[Ni(C10H8N2)3]2[V4O12]·11H2O». Acta Crystallographica Section C Crystal Structure Communications 54: 616. doi:10.1107/S0108270197018751.
- ↑ V. W. Day, Walter G. Klemperer, O. M. Yaghi (1989). «A new structure type in polyoxoanion chemistry: synthesis and structure of the V5O143− anion». J. Am. Chem. Soc. 111: 4518. doi:10.1021/ja00194a068.
- ↑ Hou D., Hagen K.D., Hill C.L. (1992). «Tridecavanadate, [V13O34]3−, a new high-potential isopolyvanadate». J. Am. Chem. Soc. 114: 5864. doi:10.1021/ja00040a061.
- ↑ Müller A., Sessoli R., Krickemeyer E., Bögge H., Meyer J., Gatteschi D., Pardi L., Westphal J., Hovemeier K., Rohlfing R., Döring J, Hellweg F., Beugholt C., Schmidtmann M. (1997). «Polyoxovanadates: High-Nuclearity Spin Clusters with Interesting Host-Guest Systems and Different Electron Populations. Synthesis, Spin Organization, Magnetochemistry, and Spectroscopic Studies». Inorg. Chem. 36: 5239. doi:10.1021/ic9703641.
- ↑ Jouanneau, S.; Verbaere, A.; Guyomard, D. (2003). «On a new calcium vanadate: synthesis, structure and Li insertion behaviour». Journal of Solid State Chemistry 172: 116. doi:10.1016/S0022-4596(02)00164-0.
- ↑ Vogel. Química Analítica Cuantitativa. 6a ed. Ed. Kapelusz
