Sustrato (bioquímica)
En bioquímica, un sustrato es una molécula fijada en el sitio activo y sobre la que actúa la enzima[1]. Las enzimas catalizan reacciones químicas que involucran sustrato(s). El sustrato se une al sitio activo de la enzima, y se forma un complejo enzima-sustrato. Por acción de la enzima, el sustrato se transforma en producto, se libera del sitio activo y queda libre para recibir otro sustrato. La ecuación general es la siguiente:
E + S ⇌ ES → EP ⇌ E + P
donde E = enzima, S = sustrato(s), P = producto(s) (Nótese que solo el paso del medio es irreversible.)Mediante el incremento de la concentración de sustrato, la velocidad de la reacción aumentará debido al aumento de la probabilidad de formación de complejos enzima-sustrato (ver teoría de las colisiones). Esto ocurrirá hasta que no haya más enzimas disponibles para la formación de complejos enzima-sustrato, lo que corresponde a un punto en que la velocidad ya no aumenta. La concentración de enzimas constituye el factor limitante.
La unión de sustrato a enzima: El complejo enzima-sustrato
[editar]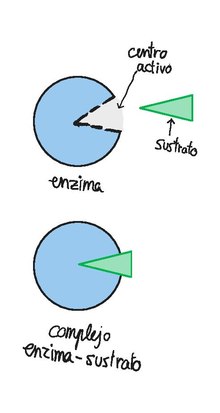
Las enzimas se unen a sustratos para dar lugar a complejos enzima-sustrato.[2] Lo más común es que estos complejos estén formados por enlaces débiles, generalmente no covalentes, de manera que la reacción pueda ser invertida ágilmente. La velocidad de la reacción directa es el resultado del producto de la concentración de sustrato por la constante de velocidad (k1), y la velocidad de la reacción inversa es el resultado de la concentración del producto multiplicada por la constante de velocidad (k2).
La constante de disociación del complejo enzima-sustrato es lo que resulta en dividir la constante de velocidad de la reacción inversa entre la constante de velocidad de la reacción directa (k2/k1). Estos cálculos son equivalentes en la formación de otros complejos como: anticuerpo-antígeno, receptor-hormona, o receptor-neurotransmisor.
La formación del complejo enzima-sustrato es posible únicamente si el sustrato posee grupos que se encuentran en la orientación tridimensional adecuada para interaccionar con los grupos de unión del centro activo. Hace falta anotar que en diversos casos la unión del sustrato puede modificar la estructura del centro activo de la enzima, lo que puede implicar un aumento de su eficacia, o una reducción (en el caso de un inhibidor enzimático).
Proximidad y orientación del sustrato
[editar]Los efectos que tiene la proximidad de los sustratos son más fáciles de entender que los de los mecanismos químicos.[3] En una reacción en que intervienen dos sustratos, ambos deben aproximarse para que se produzca la reacción. La probabilidad de que estos lo hagan depende de su concentración en la disolución. Además, esta probabilidad puede ser aumentada si el centro activo de la enzima contiene grupos de unión adyacentes para cada sustrato, lo que puede aumentar la concentración efectiva de sustratos en mil veces.
Aun cuando se produce una colisión entre los dos sustratos es muy poco probable que estos estén orientados de manera correcta para que se produzca la reacción. Es por este motivo que las propiedades del centro activo son tan importantes al darse la reacción; este une los sustratos de una manera que su orientación ya es favorable para la realización de la reacción, y facilita el intercambio de electrones, lo que favorece la formación del complejo activado.
Factores que influyen en la reacción entre sustratos
[editar]Aumentar la concentración de sustrato acelera la reacción. Por lo que, a mayor concentración de sustratos, mayor es la velocidad de reacción de estos. No obstante, esta velocidad tiene un valor máximo relacionado con la concentración de enzima. Para una elevada concentración de sustrato, es necesaria una elevada concentración de enzima para que sea eficaz, puesto que llega un punto en que todas las enzimas están saturadas con los sustratos correspondientes; a partir de aquí, un aumento de concentración de sustrato es inútil ya que necesita de enzimas libres para que tenga lugar la reacción.
Centro de fijación del sustrato
[editar]Un centro de fijación del sustrato reside en una región determinada de la superficie enzimática, es un ordenamiento en particular de las cadenas laterales de aminoácidos del polipéptido dispuesto especialmente para fijar un sustrato específico. Algunos enzimas tienen una especificidad extensa; la hexoquinasa fosforila glucosa, manosa y fructosa, mientras que la glucoquinasa es específica para glucosa. El centro de fijación del sustrato puede estar integrado dentro del centro activo. En algunos casos, no obstante, puede darse que el centro activo no esté dentro de fijación del sustrato, sino que sea contiguo a éste en la secuencia primaria. En otros casos, el centro activo se sitúa en zonas distantes de la secuencia primaria, antes bien, debido al plegamiento de la estructura terciaria, se coloca adyacentemente al centro de fijación del sustrato.[5]
Tipos de sustratos
[editar]Sustrato exógeno Los sustratos exógenos denominados con frecuencia xenobióticos, que indica “extraño a la vida”, son importantes sustratos de formas de citocromo P450. Entre ellos se incluyen fármacos terapéuticos, productos químicos utilizados en el lugar de trabajo, subproductos industriales que se convierten en contaminantes ambientales y aditivos de alimentos.[6]
Sustratos proquirales Estos sustratos tienen dos sustituyentes idénticos y dos grupos adicionales disímiles en el mismo carbono (Caa’bd), que no poseen actividad óptica, pero se pueden convertir en compuestos quirales, en otras palabras, que poseen un centro asimétrico. De este modo, la enzima sólo es capaz de reconocer una configuración específica de la molécula simétrica. Se induce asimetría en el producto por modificación de un lado del sustrato fijado.[7]
Sustrato suicida Sustrato suicida, como el nombre sugiere, hace que la enzima “se suicide”, también se denomina inhibidor basado en el mecanismo. Es un inhibidor enzimático, como FdUMP, que solo inactiva una enzima después de que transcurre parte o toda su reacción catalizadora normal.[8]
Un sustrato suicida en sí mismo no es tóxico para las células, pero es similar a un metabolito normal que experimenta una transformación metabólica, generando un producto que inhibe una enzima esencial. La célula “se suicida” al transformar el análogo en un producto tóxico. En este caso, el fluoroacetato se convierte en fluoroacetil-CoA, que funciona como sustrato del citrato sintasa. No obstante, el fluorocitrato resultante no puede ser atacado por la aconitasa.[9]
Modelos de complementariedad entre el sustrato y la enzima
[editar]Hay varios modelos de la complementariedad entre el sustrato y el enzima:
En primer lugar, el modelo de la "llave y cerradura": en la superficie enzimática existe una impresión negativa del sustrato, el sustrato encaja en su centro de fijación de la misma manera que una llave entra en la cerradura adecuada. Los enlaces iónicos y puentes de hidrógeno, así como las interacciones hidrofóbicas, ayudan a la unión del sustrato al centro de fijación.
En segundo lugar, el acoplamiento o encaje inducido: es un modelo más flexible del centro de fijación, en el que el centro de fijación y el centro activo no están completamente preformados. La interacción del sustrato con la enzima induce un cambio conformacional en la enzima que tiene como resultado la formación de un centro de fijación más fuerte y la redisposición de los aminoácidos adecuados para formar el centro activo.[10]
Referencias
[editar]- ↑ L. Nelson, M. Cox, David, Michael. «6.2 Funcionamiento de los enzimas». En Omega BCN,S.L., ed. Principios de bioquímica, séptima edición. p. 192. ISBN 978-84-282-1667-8.
- ↑ Newsholme, Eric; Leech, Tony (2010). «Enzymes: Activities, Properties, Regulation and Physiology». En Mary Board, ed. Functional Biochemistry in Health and Disease (en inglés). Wiley-Blackwell. p. 37. ISBN 978 0 471 98820 5.
- ↑ Newsholme, Eric; Leech, Tony (2010). «Enzymes: Activities, Properties, Regulation and Physiology». En Mary Board, ed. Functional Biochemistry in Health and Disease (en inglés). Wiley-Blackwell. pp. 39-40. ISBN 978 0 471 98820 5.
- ↑ «repaso de enzimas».
- ↑ York, J. Lyndal (2004). «capitulo 10, enzimas: clasificación, cinética y control». En Dr. Claudi M. Cuchillo, ed. Bioquímica, libro de texto con aplicaciones clínicas, cuarta edición,. reverté. pp. P414-415. ISBN 84-291-7208-4.
- ↑ T. Okita, Sue Siler Masters,, Richard, Bettie (2004). «11». Bioquímica, libro de texto con aplicaciones clínicas, cuarta edición. reverté. p. 476. ISBN 84-291-7208-4.
- ↑ Lyndal York, J. (2004). «10». Bioquímica, libro de texto con aplicaciones clínicas, cuarta edición. reverté. p. 443. ISBN 84-291-7208-4.
- ↑ Voet; G. Voet, Donald; Judith (2006). «capítulo 28, Metabolismo de los nucleótidos». Bioquimica, 3a edición. panamericana. p. 1134. ISBN 978-950-06-2301-8.
- ↑ K. Mathews, van Holde, G. Ahern, Christopher, K. E., Kevin (2002). «capitulo 14, procesos oxidativos: ciclo del ácido cítrico y ruta de las pentosas fosfato». En Isabel Capella, ed. Bioquímica, tercera edición. Pearson educación. p. 557. ISBN 978-84-7829-053-6.
- ↑ Lyndal York, J. (2004). «capitulo 10, enzimas: clasificación, cinética y control». Bioquímica, libro de texto con aplicaciones clínicas, cuarta edición. reverté. p. P441. ISBN 84-291-7208-4.
