Enlace π

En química, los enlaces pi (enlaces π) son enlaces químicos covalentes donde dos lóbulos de un orbital involucrado en el enlace solapan con dos lóbulos del otro orbital involucrado. Se identifican por la falta de densidad electrónica a lo largo de su eje internuclar.
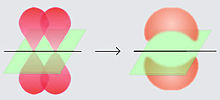
La letra griega π en su nombre se refiere a los orbitales p, dado que la simetría de los orbitales de los enlaces pi es la misma que la de los orbitales p. Generalmente, los orbitales p están involucrados en este tipo de enlace. Se asume que los orbitales d también participan en el enlace pi, pero esto no es necesariamente el caso en la realidad, aunque el concepto de enlace por medio de orbitales d explica bien la hipervalencia.
Los enlaces pi son generalmente más débiles que los enlaces sigma, porque su densidad electrónica negativamente cargada está más lejos de la carga positiva del núcleo atómico, lo que requiere más energía. Desde la perspectiva de la mecánica cuántica, la debilidad del enlace se explica por el traslape significativamente menor entre los componentes de los orbitales p, debido a la orientación paralela.
Aunque los enlaces pi por sí mismos son más débiles que un enlace sigma, los enlaces pi son componentes frecuentes de los enlaces múltiples, junto con los enlaces sigma. La combinación de enlace pi y enlace sigma es más fuerte que cualquiera de los enlaces por sí solo. El aumento de la fuerza de un enlace múltiple comparado con un enlace simple (enlace sigma) está indicado de varias formas, pero la más evidente es la contracción de la longitud de enlace. Por ejemplo, en química orgánica, la longitud de enlace carbono-carbono en el etano es (154 pm), etileno (133 pm) y acetileno (120 pm).
Además del enlace sigma, un par de átomos conectados por un enlace doble, enlace triple, enlace cuádruple o enlace quíntuple pueden tener uno, dos, tres o cuatro enlaces pi, respectivamente. Los enlaces pi resultan del traslape de orbitales atómicos que tienen dos áreas de traslape. Los enlaces pi son más difusos que los enlaces sigma. Los electrones en los enlaces pi son referidos algunas veces como electrones pi. Los fragmentos moleculares unidos por un enlace pi no pueden rotar libremente alrededor del enlace sin la ruptura del enlace pi, porque la rotación involucra la destrucción de la orientación paralela de los orbitales p constituyentes.
Casos especiales
[editar]La presencia de enlaces pi no necesariamente se da siempre en conjunción con la presencia de enlaces sigma, se conocen también casos en los que dos átomos se enlazan únicamente mediante enlaces pi.
En algunos complejos metálicos, las interacciones pi entre un átomo metálico y los orbitales antienlazantes pi de un alquino o un alqueno forman enlaces pi.
En ciertos casos de enlaces múltiples entre dos átomos, no hay enlaces sigma del todo, solo enlaces pi. Tales casos incluyen, por ejemplo, el hexacarbonildihierro (Fe2(CO)6), dicarbono (C2) y el borano B2H2. En estos compuestos, los enlaces centrales consisten solo de enlaces pi, y para conseguir el máximo traslape de orbitales, la longitud de enlace es mucho menor de la esperada.[1]
Véase también
[editar]Referencias
[editar]- ↑ Bond length and bond multiplicity: σ-bond prevents short π-bonds Eluvathingal D. Jemmis, Biswarup Pathak, R. Bruce King, Henry F. Schaefer III Chemical Communications, 2006, 2164 - 2166 Abstract
