Diferencia entre revisiones de «Enlace covalente»
m Revertidos los cambios de 190.67.149.38 a la última edición de LMLM |
|||
| Línea 23: | Línea 23: | ||
* Son insolubles. |
* Son insolubles. |
||
* Son neocloridas |
* Son neocloridas |
||
simples : |
|||
forma un electron molecular |
forma un electron molecular |
||
Revisión del 17:36 28 jul 2010
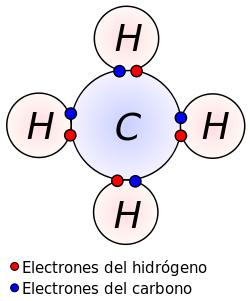
Un enlace covalente se produce por compartición de electrones entre dos átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos puede compartirse uno, dos o tres electrónes, lo cual dará lugar a la formación de un enlace simple, doble o triple. En representación de Lewis estos enlaces pueden representarse por una pequeña línea entre los átomos.
Tipos de enlace covalente
Existen dos tipos de sustancias covalentes:
Sustancias covalentes moleculares: los enlaces covalentes forman moléculas que tienen las siguientes propiedades:
- Temperaturas de fusión y ebullición bajas.
- En condiciones normales (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos
- Son blandos en estado sólido.
- Son aislantes de corriente eléctrica y calor.
- Solubilidad: las moléculas polares son solubles en disolventes polares y las apolares son solubles en disolventes apolares (semejante disuelve a semejante).
Redes: además las sustancias covalentes forman redes, semejantes a los compuestos iónicos, que tienen estas propiedades:
- Elevadas temperaturas de fusión y ebullición.
- Son sólidos
- Son sustancias muy duras (excepto el grafito).
- Son aislantes (excepto el grafito).
- Son insolubles.
- Son neocloridas
simples : forma un electron molecular
Moléculas poliatómicas
Polaridad del enlace covalente
Consideremos átomos del hidrógeno, a medida que se aproximan entre sí, se van haciendo notar las fuerzas que atraen a cada electrón al núcleo del otro átomo, hasta que dichas fuerzas de atracción se llegan a compensar con la repulsión que los electrones sienten entre sí. En ese punto, la molécula presenta la configuración más estable.
Lo que ha sucedido es que los orbitales de ambos electrones se han solapado, de modo que ahora es imposible distinguir a qué átomo pertenece cada uno de los electrones.
Sin embargo, cuando los átomos son distintos, los electrones compartidos no serán atraídos por igual, de modo que estos tenderán a aproximarse hacia el átomo más electronegativo, es decir, aquel que tenga una mayor apetencia de electrones. Este fenómeno se denomina polaridad (los átomos con mayor electronegatividad obtienen una polaridad más negativa, atrayendo los electrones compartidos hacia su núcleo), y resulta en un desplazamiento de las cargas dentro de la molécula.
Se podría decir que al átomo más electronegativo no le gusta mucho compartir sus electrones con los demás átomos, y en el caso más extremo, deseará que el electrón le sea cedido sin condiciones formándose entonces un enlace iónico, de ahí que se diga que los enlaces covalentes polares tienen, en alguna medida, carácter iónico.
Cuando la diferencia de electronegatividades es nula (dos átomos iguales), el enlace formado será covalente puro ; para una diferencia de electronegatividades de 1,7 el carácter iónico alcanza ya el 35%, y para una diferencia de 3, será del 49.5%.
Así pues, para diferencias de electronegativades mayores de 3 el enlace será predominantemente de carácter iónico, como sucede entre el oxígeno o flúor con los elementos de los grupos 1 y 2; sin embargo, cuando está entre 0 y 1,7 será el carácter covalente el que predomine, como es el caso del enlace C-H. No obstante, según el químico Raymond Chang, esta diferencia de electronegatividad entre los átomos debe ser 2,0 o mayor para que el enlace sea considerado iónico (Chang, 371).(bibliografía abajo)
Dependiendo de la diferencia de electronegatividad, el enlace covalente puede ser clasificado en covalente polar y covalente puro o apolar. Si la diferencia de electronegatividad está entre 0,4 y 1,7 es un enlace covalente polar, y si es inferior a 0,4 es covalente apolar.
Enlace covalente polarizado
Cuando un mismo átomo aporta el par electrónico, el enlace covalente es llamado enlace covalente polarizado. Aunque las propiedades de enlace covalente coordinado son parecidas a las de un enlace covalente normal (dado que todos los electrones son iguales, sin importar su origen), la distinción es útil para hacer un seguimiento de los electrones de valencia y asignar cargas formales. Una base dispone de un par electrónico para compartir y un ácido acepta compartir el par electrónico para formar un enlace covalente coordinado.
Se produce en elementos iguales, es decir, con una misma electronegatividad por lo que su resultado es 0. Un átomo no completa la regla del octeto.
Características del enlace covalente polarizado
- Enlace sencillo: Se comparten dos electrones de la capa de valencia. Ej: F-F
- Enlace doble: Se comparten cuatro electrones, en dos pares, de la capa de valencia. Ej: Cl=Cl
- Enlace triple: se comparten 6 electrones en 3 pares de electrones de la capa de valencia. Ej: NΞN
- Enlace cuádruple: es la unión de 8 electrones en cuatro pares de la capa de valencia. Ej: CC
- En general cuando un átomo comparte los dos electrones de un solo para se llama enlace covalente dativo y se suele representar con una flecha (→)
Tipo de enlaces y reactividad de una sustancia
En los enlaces sigma pueden ocurrir las siguientes reacciones (reacciones químicas):
- Sustitución, donde un átomo es sustituido por otro. Lo reemplaza.
- Eliminación, donde un átomo se elimina de la molécula. Generalmente en esta reacción se forma un enlace pi.
Sobre los enlaces pi ocurre la adición, donde se agregan por lo general dos átomos y se forman dos enlaces sigma. En el ejemplo se muestra la adición de un sólo átomo:
- Los enlaces sigma no polares de un átomo saturado son muy poco reactivos y para fines prácticos podemos considerarlos inertes.
- Los enlaces sigma no polares que entran a un átomo insaturado son algo más reactivos, por el efecto del enlace pi.
- Los enlaces sigma polares son reactivos.
- Los enlaces pi son reactivos.
Otro tipo de reacción es la transposición, donde se redistribuyen los átomos existentes para formar un isómero de la substancia original. Esta puede ocurrir en cualquier molécula sin importar el tipo de enlace y el número de enlaces que cambian de lugar, siempre es par.
