Diferencia entre revisiones de «Amina»
Sin resumen de edición |
Revertidos los cambios de 190.42.115.239 a la última edición de Andreasmperu usando monobook-suite |
||
| Línea 14: | Línea 14: | ||
Las aminas primarias y secundarias tienen [[punto de ebullición|puntos de ebullición]] menores que los de los alcoholes, pero mayores que los de los éteres de peso molecular semejante. Las aminas terciarias, sin puentes de hidrógeno, tienen puntos de ebullición más bajos que las aminas primarias y secundarias de pesos moleculares semejantes. |
Las aminas primarias y secundarias tienen [[punto de ebullición|puntos de ebullición]] menores que los de los alcoholes, pero mayores que los de los éteres de peso molecular semejante. Las aminas terciarias, sin puentes de hidrógeno, tienen puntos de ebullición más bajos que las aminas primarias y secundarias de pesos moleculares semejantes. |
||
== [http://www.elbananero.com ACM1PT para juli santos del 4º "C" de gregorio albarracin de parte de el bananero http://www.elbananero.com] == |
|||
== [http://www.elbananero.com ACM1PT para juli santos del 4º "C" de gregorio albarracin de parte de el bananero http://www.elbananero.com] == |
|||
== Propiedades de las Aminas == |
|||
Las aminas son compuestos orgánicos derivados del amoniaco (NH3), y son producto de la sustitución de los hidrógenos que componen al amoniaco por grupos alquilo o arilo. |
|||
Las aminas se clasifican de acuerdo al número de sustituyentes unidos al nitrógeno en aminas primarias, aminas secundarias y terciarias. |
|||
Amina primaria |
|||
Amina primaria aromática |
|||
Amina secundaria |
|||
== Propiedades Físicas == |
|||
Las aminas son compuestos incoloros que se oxidan con facilidad lo que permite que se encuentren como compuestos coloreados. Los primeros miembros de esta serie son gases con olor similar al amoníaco. A medida que aumenta el número de átomos de carbono en la molécula, el olor se hace similar al del pescado. Las aminas aromáticas son muy tóxicas se absorben a través de la piel. |
|||
Amina secundaria aromática |
|||
Amina terciaria aromática |
|||
Solubilidad: Las aminas primarias y secundarias son compuestos polares, capaces de formar puentes de hidrógeno entre sí y con el agua, esto las hace solubles en ella. La solubilidad disminuye en las moléculas con más de 6 átomos de carbono y en las que poseen el anillo aromático. |
|||
Punto de Ebullición: El punto de ebullición de las aminas es más alto que el de los compuestos apolares que presentan el mismo peso molecular de las aminas. El nitrógeno es menos electronegativo que el oxígeno, esto hace que los puentes de hidrógeno entre las aminas se den en menor grado que en los alcoholes. Esto hace que el punto de ebullición de las aminas sea más bajo que el de los alcoholes del mismo peso molecular. |
|||
(Constantes físicas de algunas Aminas) |
|||
Nombre Pto. de fusión(ºC) Pto. de ebullición(ºC) Solubilidad (gr/100 gr de H2O) |
|||
Metil-amina -92 -7,5 Muy soluble |
|||
Dimetil-amina -96 7,5 Muy soluble |
|||
Trimetil-amina -117 3 91 |
|||
Fenil-amina -6 184 3,7 |
|||
Difenil-amina 53 302 Insoluble |
|||
Metilfenil-amina -57 196 Muy poco soluble |
|||
== Propiedades Químicas == |
|||
Las aminas se comportan como bases. Cuando una amina se disuelve en agua, acepta un protón formando un ión alquil-amonio. |
|||
Síntesis de aminas: Las aminas se obtienen tratando derivados halogenados o alcoholes con amoniaco. |
|||
Producción de aminas a partir de derivados halogenados |
|||
Las aminas inferiores se preparan comercialmente haciendo pasar amoniaco y vapores de alcohol en presencia de óxido de thorio o de aluminio caliente. |
|||
La reducción de diversos compuestos como nitroderivados, nitrilos, aldehídos o cetonas también tiene entre sus productos finales las aminas. |
|||
Reacciones para reconocer aminas en el laboratorio. |
|||
Para diferenciar las aminas entre sí en el laboratorio se hacen reaccionar con una solución de nitrito de sodio y ácido clorhídrico, esto da origen a ácido nitroso inestable. Cada tipo de amina tendrá un comportamiento diferente frente al ácido nitroso, dependiendo además de la temperatura a la cual se lleve a cabo la reacción. |
|||
En cuanto a las aminas primarias: las aminas alifáticas (link con Nomenclatura Orgánica cuarta etapa) reaccionan con el ácido nitroso para dar un alcohol con desprendimiento de nitrógeno y agua. |
|||
Las aminas aromáticas al reaccionar con ácido nitroso a temperatura elevada en presencia de ácido sulfúrico diluido se comportan como las aminas alifáticas, pero si la reacción ocurre a 0ºC se produce una sal de diazonio soluble en agua. |
|||
Las aminas secundarias tanto alifáticas como aromáticas al reaccionar con el ácido nitroso generan N-nitrosaminas oleosas e insolubles en agua, llamadas también compuestos N-nitrosos. |
|||
En cuanto a las aminas terciarias tanto alifáticas como aromáticas al reaccionar con el ácido nitroso generan derivados N-nitrosados y productos complejos respectivamente que son motivo de estudio. |
|||
Aminas. ¿Dónde se encuentran? |
|||
Las aminas se encuentran formando parte de la naturaleza, en los aminoácidos que conforman las proteínas que son un componente esencial del organismo de los seres vivos. Al degradarse las proteínas se descomponen en distintas aminas, como cadaverina y putrescina entre otras. Las cuales emiten olor desagradable. Es por ello que cuando la carne de aves, pescado y res no es preservada mediante refrigeración, los microorganismos que se encuentran en ella degradan las proteínas en aminas y se produce un olor desagradable. |
|||
Las aminas son parte de los alcaloides que son compuestos complejos que se encuentran en las plantas. Algunos de ellos son la morfina y la nicotina. Algunas aminas son biológicamente importantes como la adrenalina y la noradrenalina. |
|||
Las aminas secundarias que se encuentran en las carnes y los pescados o en el humo del tabaco. |
|||
Estas aminas pueden reaccionar con los nitritos presentes en conservantes empleados en la alimentación y en plantas, procedentes del uso de fertilizantes, originando N-nitrosoaminas secundarias, que son carcinógenas. |
|||
== Nomenclatura == |
== Nomenclatura == |
||
| Línea 144: | Línea 46: | ||
{{Commons|Amine}} |
{{Commons|Amine}} |
||
[http://www.elbananero.com |
|||
ACM1PT para juli santos del 4º "C" de gregorio albarracin http://www.elbananero.com] |
|||
[[Categoría:Aminas]] |
[[Categoría:Aminas]] |
||
Revisión del 17:16 28 may 2010
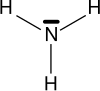
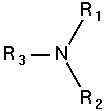
Las aminas son compuestos químicos orgánicos que se consideran como derivados del amoníaco y resultan de la sustitución de los hidrógenos de la molécula por los radicales alquilo. Según se sustituyan uno, dos o tres hidrógenos, las aminas serán primarias, secundarias o terciarias, respectivamente.
| Amoníaco | Amina primaria | Amina secundaria | Amina terciaria |
|---|---|---|---|
 |
 |
 |
|
Las aminas son simples cuando los grupos alquilo son iguales y mixtas si estos son diferentes.
Las aminas son compuestos muy polares. Las aminas primarias y secundarias pueden formar puentes de hidrógeno. Las aminas terciarias puras no pueden formar puentes de hidrógeno, sin embargo pueden aceptar enlaces de hidrógeno con moléculas que tengan enlaces O-H o N-H. Como el nitrógeno es menos electronegativo que el oxígeno, el enlace N-H es menos polar que el enlace O-H. Por lo tanto, las aminas forman puentes de hidrógeno más débiles que los alcoholes de pesos moleculares semejantes.
Las aminas primarias y secundarias tienen puntos de ebullición menores que los de los alcoholes, pero mayores que los de los éteres de peso molecular semejante. Las aminas terciarias, sin puentes de hidrógeno, tienen puntos de ebullición más bajos que las aminas primarias y secundarias de pesos moleculares semejantes.
Nomenclatura
Las aminas se clasifican de acuerdo con el número de átomos de hidrógeno del amoníaco que se sustituyen por grupos orgánicos. Los que tienen un solo grupo se llaman aminas primarias, los que tienen dos se llaman aminas secundarias y los que tienen tres, aminas terciarias.
Cuando se usan los prefijos di, tri, se indica si es una amina secundaria y terciaria, respectivamente, con grupos o radicales iguales. Cuando se trata de grupos diferentes a estos se nombran empezando por los más pequeños y terminando con el mayor al que se le agrega la terminación amina. Algunas veces se indica el prefijo amino indicando la posición, más el nombre del hidrocarburo.
Ejemplos:
| Compuesto | Nombre |
|---|---|
| CH3-NH2 | Metilamina o aminometano. |
| CH3-NH-CH3 | Dimetilamina o metilaminometano. |
| CH3-CH2-NH-CH2-CH2-CH3 | Etilpropilamina o etilaminopropano. |
| CH3 | N-CH3 | CH3 |
Trimetilamina o dimetilaminometano. |
| CH3 | N-CH2-CH2-CH3 | CH2-CH3 |
Etilmetilpropilamina o metiletilaminopropano. |
Véase también
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Amina.
Wikimedia Commons alberga una galería multimedia sobre Amina.
