Diferencia entre revisiones de «Óxido de calcio»
Revertidos los cambios de 89.130.156.10 a la última edición de 190.182.44.251 usando monobook-suite |
|||
| Línea 45: | Línea 45: | ||
== Enlaces externos == |
== Enlaces externos == |
||
*[http://www.luzrasante.com/el-ciclo-de-la-cal/] |
*[http://www.luzrasante.com/el-ciclo-de-la-cal/] |
||
* El calero, un oficio que se pierde [http://www.villadeorgaz.es/orgaz-calero-dedicatoria.htm] |
|||
== Véase también == |
== Véase también == |
||
Revisión del 15:27 17 nov 2009
| Óxido de calcio | ||
|---|---|---|
 | ||
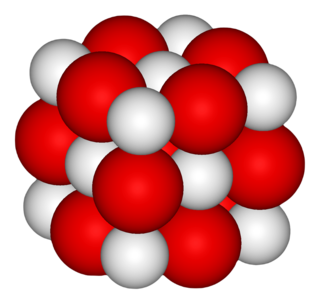 | ||
| Nombre IUPAC | ||
| Óxido de calcio | ||
| General | ||
| Otros nombres | Óxido cálcico, oxido de calcio (I) | |
| Fórmula semidesarrollada | CaO | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 1305-78-8[1] | |
| Número RTECS | EW3100000 | |
| ChEBI | 31344 | |
| ChEMBL | CHEMBL2104397 | |
| ChemSpider | 14095 | |
| DrugBank | 15648 | |
| PubChem | 14778 | |
| UNII | C7X2M0VVNH | |
| KEGG | D01679 C13140, D01679 | |
| Propiedades físicas | ||
| Apariencia | Blanco | |
| Densidad | 3300 kg/m³; 3,3 g/cm³ | |
| Masa molar | 561 g/mol | |
| Punto de fusión | 3200 K (2927 °C) | |
| Punto de ebullición | 3773 K (3500 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | Reacciona | |
| Termoquímica | ||
| ΔfH0gas | 43,93 kJ/mol | |
| ΔfH0líquido | -557,33 kJ/mol | |
| ΔfH0sólido | 635,09 kJ/mol | |
| S0gas, 1 bar | 219,71 J·mol–1·K | |
| S0líquido, 1 bar | 62,31 J·mol–1·K–1 | |
| S0sólido | 39,79 J·mol–1·K–1 | |
| Riesgos | ||
| Ingestión | Peligroso, causa irritación, en grandes dosis puede ser fatal. | |
| Inhalación | Peligroso; causa irritación, bronquitis química o la muerte en casos de exposición a largo plazo. | |
| Piel | Irritación y posibles quemaduras. | |
| Ojos | Puede causar daños permanentes. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El óxido de calcio o cal, de fórmula CaO. Esta palabra interviene en el nombre de otras sustancias, como por ejemplo la «cal apagada» o «cal muerta», que es hidróxido de calcio, Ca(OH)2.
También se denomina cal viva. Antiguamente se usaba «cal» en vez de «calcio», en algunos nombres de compuestos donde interviene este elemento, como el "talco" o "aljez" (sulfato de calcio dihidratado, CaSO4•2H2O) o el mármol o "gis" (carbonato de calcio, CaCO3).
Los depósitos sedimentarios de carbonato de calcio se llaman caliches.
Este material utilizado para hacer mortero de cal se obtiene de las rocas calizas calcinadas a una temperatura entre 900 y 1200 °C, durante días, en un horno rotatorio o en un horno tradicional, romano o árabe. En estas condiciones el carbonato es inestable y pierde una molécula de óxido de carbono (IV).
El óxido de calcio reacciona violentamente con el agua, haciendo que ésta alcance los 90 °C. Se forma entonces hidróxido de calcio, también llamado cal apagada, o Ca (OH)2.
Por eso, si entra en contacto con seres vivos, deshidrata sus tejidos (ya que estos están formados por agua).
El hidróxido de calcio reacciona otra vez con el óxido de carbono (IV) del aire para formar de nuevo carbonato de calcio (cal). En esta reacción la masa se endurece. Por esto el óxido de calcio forma parte de formulaciones de morteros, especialmente a la hora de enlucir paredes de color blanco.
La cal se ha usado, desde la más remota antigüedad, de conglomerante en la construcción; también para pintar (encalar) muros y fachadas de los edificios construidos con adobes o tapial, habitual en las antiguas viviendas mediterráneas, en la fabricación de fuego griego. En algunos países de Latinoamérica, la cal se utiliza para el proceso de nixtamal, proceso utilizado para hacer sémola de maíz y masa para tortillas.
