Diferencia entre revisiones de «Ozono»
m Revertidos los cambios de Piero ansaldo a la última edición de Diegusjaimes |
|||
| Línea 69: | Línea 69: | ||
== Descubrimiento == |
== Descubrimiento == |
||
El ozono fue descubierto en 1785 |
El ozono fue descubierto en 1785 por el físico holandés Martinus Van Marum trabajando con maquinas electrostáticas, en las cuales percibió el olor de un gas (ozono). En mayo de [[1840]] el químico alemán [[Christian Frederick Schönbein|Christian Schönbein]], de la Universidad de Basilea, lo nombró ozono, raíz griega que significa ''Ozein'' (exhalar un olor, sentir). En 1863 Soret estableció la relación entre el oxígeno y el ozono , al encontrar que 3 volúmenes de oxígeno producían 2 volúmenes de ozono. |
||
== Aplicaciones == |
== Aplicaciones == |
||
Revisión del 21:51 8 sep 2009
| Ozono | |
|---|---|
| Archivo:Ozon Molecular-Forms.png | |
| Archivo:Ozone formation.png | |
| General | |
| Nombre sistemático | Trioxígeno |
| Fórmula molecular | O3 |
| Masa molar | 47,998 g/mol |
| Apariencia | Gas azul pálido |
| N° CAS | [10028-15-6] |
| Propiedades físicas | |
| Densidad y fase | 2,144 g/l (0 °C), gas |
| Solubilidad en el agua | 0,105 g/100 ml (0 °C) |
| Punto de fusión | −197,2 °C |
| Punto de ebullición | −111,9 °C |
| Propiedades termodinámicas | |
| Entalpía estándar de formación ΔfH°sólido |
+142,3 kJ/mol |
| Entropía molar estándar S°sólido |
237,7 J.K−1.mol−1 |
| Peligros | |
| Clasificación CE | no listado |
| Salvo excepción, estos valores se dan para Condiciones normales de temperatura y de presión | |
El ozono (O3), es una sustancia cuya molécula está compuesta por tres átomos de oxígeno, formada al disociarse los 2 átomos que componen el gas de oxígeno. Cada átomo de oxígeno liberado se une a otra molécula de oxígeno (O2), formando moléculas de Ozono (O3).
A temperatura y presión ambientales el ozono es un gas de olor acre y generalmente incoloro, pero en grandes concentraciones puede volverse ligeramente azulado. Si se respira en grandes cantidades, es tóxico y puede provocar la muerte.
Se descompone rápidamente en presencia de oxígeno a temperaturas mayores de 100º C y en presencia de catalizadores como el dióxido de manganeso (MnO2) a temperatura ambiente.
Descubrimiento
El ozono fue descubierto en 1785 por el físico holandés Martinus Van Marum trabajando con maquinas electrostáticas, en las cuales percibió el olor de un gas (ozono). En mayo de 1840 el químico alemán Christian Schönbein, de la Universidad de Basilea, lo nombró ozono, raíz griega que significa Ozein (exhalar un olor, sentir). En 1863 Soret estableció la relación entre el oxígeno y el ozono , al encontrar que 3 volúmenes de oxígeno producían 2 volúmenes de ozono.
Aplicaciones
El ozono se puede producir artificialmente mediante un generador de ozono.
El ozono tiene un interesante uso industrial como precursor en la síntesis de algunos compuestos orgánicos, y sobre todo, como desinfectante (depuradoras). Su principal propiedad es que es un fortísimo oxidante. Sin embargo es más conocido por el importante papel que desempeña en la atmósfera. A este nivel es necesario distinguir entre el ozono presente en la estratosfera y el de la troposfera. En ambos casos su formación y destrucción son fenómenos fotoquímicos.
Cuando el oxígeno del aire es sujeto a un pulso de alta energía, el doble enlace O=O del oxígeno se rompe entregando dos átomos de oxígeno los cuales luego se recombinan. Estas moléculas recombinadas contienen tres átomos de oxígeno en vez de dos, lo que da origen al Ozono.
Este O3 produce la eliminación absoluta de bacterias, virus, hongos, parásitos y olores presentes en el aire.
Ozono atmosférico
El ozono atmosférico se encuentra en estado puro en diferentes concentraciones entre los 10 y los 40 km sobre el nivel del mar, siendo su concentración más alta alrededor de los 25 km (Ozonosfera), es decir en la estratosfera.
Actúa en la atmósfera como depurador del aire y sobre todo como filtro de los rayos ultravioletas procedentes del Sol. Sin ese filtro la existencia de vida en la Tierra sería del todo imposible, de ahí la gran importancia de la llamada “Capa de Ozono”. El ozono en su forma natural es un gas de color azul y de un olor picante muy característico. Se licua a -111,9 ºC y se solidifica a -193ºC.
El color azul del cielo es debido precisamente a la presencia de este gas.
El ozono a concentraciones del 100% es altamente tóxico para el ser humano.
La primera vez que se utilizó el ozono como terapia médica fue durante la I Guerra Mundial sobre las heridas de guerra viéndose que estas cicatrizaban mejor y más rápidamente que las tratadas con los métodos habituales de la época.
Hoy en día la ozonoterapia se practica en prácticamente todos los países tanto europeos como americanos, incluso en ciertos países como es el caso de Italia y Alemania entra dentro de las prestaciones de la Seguridad Social.
Ozono estratosférico
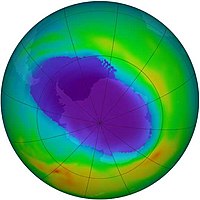
El ozono se encuentra de forma natural en la estratosfera, formando la denominada capa de ozono. El ozono estratosférico se forma por acción de la radiación ultravioleta, que disocia las moléculas de oxígeno molecular (O2) en dos átomos, los cuales son altamente reactivos, pudiendo reaccionar estos con otra molécula de O2 formándose el ozono.
El ozono se destruye a su vez por acción de la propia radiación ultravioleta, ya que la radiación con longitud de onda menor de 290 nm hace que se desprenda un átomo de oxígeno de la molécula de ozono. Se forma así un equilibrio dinámico en el que se forma y destruye ozono, consumiéndose de esta forma la mayoría de la radiación de longitud de onda menor de 290 nm. Así, el ozono actúa como un filtro que no deja pasar dicha radiación perjudicial hasta la superficie de la Tierra.
El equilibrio del ozono en la estratosfera se ve afectado por la presencia de contaminantes, como pueden ser los compuestos clorofluorocarbonados (CFCs), que suben hasta la alta atmósfera donde catalizan la destrucción del ozono más rápidamente de lo que se regenera, produciendo así el agujero de la capa de ozono. El daño que causan cada uno de estos contaminantes es función de su potencial de agotamiento del ozono, esto fue descubierto por el Ingeniero Químico mexicano Mario Molina, Premio Nobel de Química en 1995.
Para medir la concentración de ozono en la atmósfera se utilizan instrumentos en satélites tales como GOMOS en el satélite Envisat.
Ozono troposférico
Sin embargo, también podemos encontrar ozono (O3) en la zona más baja de la atmósfera, convirtiéndose en un problema, puesto que el ozono, en concentración suficiente puede provocar daños en la salud humana (a partir de unos 150 microgramos por metro cúbico) o en la vegetación (a partir de unos 30 ppb (partes por billón)). Estas características del ozono han propiciado que dentro de la Unión Europea aparezca una normativa relativa al ozono en el aire ambiente, que establece el nuevo régimen jurídico comunitario sobre el ozono troposférico presente en la baja atmósfera.
El mecanismo mediante el cual se genera el ozono en la troposfera es completamente distinto, ya que a esta altura no llegan las radiaciones ultravioletas. El ozono en este caso, se forma a partir de ciertos precursores (NOx - óxidos de nitrógeno; y VOCs - compuestos orgánicos volátiles, como el formaldehído), contaminantes provenientes de la actividad humana. Estos contaminantes se disocian formando radicales con radiación menos energética, y dichos radicales pueden formar ozono con el oxígeno molecular. El conjunto del ozono, NOx y VOCs forma una neblina visible en zonas muy contaminadas denominada smog fotoquímico.
Véase también
Enlaces externos
- Aplicaciones del Ozono. Preguntas Frecuentes
- Ozono y formas de obtención
- Estructura molecular del ozono
- Ozono estratosférico
- La Atmósfera de la Tierra
- Efectos del ozono sobre la salud, resumen realizado por GreenFacts de un informe de la OMS.
- Producción de energía limpia, Bio-gas.
