Diferencia entre revisiones de «Grafito»
Sin resumen de edición |
Deshecha la edición 26708818 de 80.26.76.102 (disc.) |
||
| Línea 1: | Línea 1: | ||
[[Imagen:GraphiteUSGOV.jpg|thumb|right|Grafito]] |
[[Imagen:GraphiteUSGOV.jpg|thumb|right|Grafito]] |
||
El '''grafito''' es una de las formas [[Alotropía|alotrópicas]] en las que se puede presentar el [[carbono]] junto al [[diamante]] y los [[fulereno]]s. A presión atmosférica y temperatura ambiente es más estable el grafito que el diamante, sin embargo la descomposición del diamante es tan extremadamente lenta que sólo es apreciable a escala geológica. |
|||
Fue nombrado por Abraham Gottlob Werner en el año 1789 y el término grafito deriva del griego γραφειν (graphein) que significa escribir. También se denomina plumbagina y plomo negro. |
Fue nombrado por Abraham Gottlob Werner en el año 1789 y el término grafito deriva del griego γραφειν (graphein) que significa escribir. También se denomina plumbagina y plomo negro. |
||
Revisión del 00:18 28 may 2009

El grafito es una de las formas alotrópicas en las que se puede presentar el carbono junto al diamante y los fulerenos. A presión atmosférica y temperatura ambiente es más estable el grafito que el diamante, sin embargo la descomposición del diamante es tan extremadamente lenta que sólo es apreciable a escala geológica. Fue nombrado por Abraham Gottlob Werner en el año 1789 y el término grafito deriva del griego γραφειν (graphein) que significa escribir. También se denomina plumbagina y plomo negro.
El grafito se encuentra en yacimientos naturales y se puede extraer, pero también se produce artificialmente. El principal productor mundial de grafito es China, seguido de India y Brasil.
Estructura
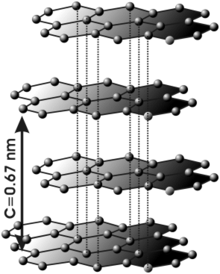
En el grafito los átomos de carbono presentan hibridación sp2, esto significa que forma tres enlaces covalentes en el mismo plano a un ángulo de 120º (estructura hexagonal) y que un orbital Π perpendicular a ese plano quede libre (estos orbitales deslocalizados son fundamentales para definir el comportamiento eléctrico del grafito) . El enlace covalente entre los átomos de una capa es extremadamente fuerte, sin embargo las uniones entre las diferentes capas se realizan por fuerzas de Van der Waals e interacciones entre los orbitales Π, y son mucho más débiles.
Esta estructura laminar hace que el grafito sea un material marcadamente anisótropo.
Propiedades
Es de color negro con brillo metálico, refractario y se exfolia con facilidad. En la dirección perpendicular a las capas presenta una conductividad de la electricidad baja y que aumenta con la temperatura, comportándose pues como un semiconductor. A lo largo de las capas la conductividad es mayor y disminuye al aumentar la temperatura, comportándose como un conductor semimetálico.
Aplicaciones
- El grafito es un material refractario y se emplea en ladrillos, crisoles, etc.
- Al deslizarse las capas fácilmente en el grafito, resulta ser un buen lubricante sólido.
- Se utiliza en la fabricación de diversas piezas en ingeniería, como pistones, juntas, arandelas, rodamientos, etc.
- Este material es conductor de la electricidad y se usa para fabricar electrodos. También tiene otras aplicaciones eléctricas.
- Se emplea en reactores nucleares, como moderadores y reflectores.
- El grafito mezclado con una pasta sirve para fabricar lápices.
- Es usado para crear discos de grafito parecidos a los de discos vinilo salvo por su mayor resistencia a movimientos bruscos de las agujas lectoras.
- Se puede crear Grafeno, el material más conductor y resistente que existe, futuro sustituto del silicio en la fabricación de chips.
Compuestos de intercalación de grafito
Distintas moléculas o iones pueden penetrar en las capas del grafito. Por ejemplo el potasio puede ceder un electrón al grafito, quedando el ion de potasio, K,entre las capas. Este electrón contribuye a aumentar la conductividad que presentaba el grafito.
Se pueden preparar diferentes compuestos de intercalación con distintas estequiometrías y distintas especies. En algunos casos la conductividad resultante es mayor, como en el caso del potasio, y es lo que ocurre generalmente, pero en otros, como por ejemplo con flúor, es menor.
Otras formas relacionadas
Existen otras formas llamadas de carbón amorfo que tienen una estructura relacionada con la del grafito:
- Carbón vegetal y carbón activado
- Negro de humo u hollín
- Grafeno
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Grafito.
Wikimedia Commons alberga una galería multimedia sobre Grafito. Wikcionario tiene definiciones y otra información sobre grafito.
Wikcionario tiene definiciones y otra información sobre grafito.- http://www.phy.mtu.edu/~jaszczak/graphite.html The Graphite Page
- Web con mucha información sobre el GRAFITO
- http://carbon.asturi.as
