Hojarasca

La hojarasca, también llamada broza,[1][2][3] corresponde al conjunto de materiales vegetales muertos, procedentes de árboles y plantas, que han caído al nivel del suelo y forman sobre él una cubierta orgánica,[4] conocida como mantillo.[5][6][7] La hojarasca se constituye de partes fenecidas y separadas de organismos vegetales, principalmente de hojas, flores, frutos y semillas, así como porciones de corteza, ramas y tallos, en cese de su continuidad orgánica y de su funcionalidad fundacional.[8] El detrito resultante, y sus nutrientes constituyentes, se agregan a la capa superior del suelo, comúnmente conocida como horizonte O, desde el cual su descomposición será fundamental en el ciclo de nutrientes del ecosistema, y en la transferencia de materia orgánica y nutrientes entre la zona aérea del bosque, y el sistema suelo.[9][10] Los principales nutrientes que son transferidos en este ciclo son el nitrógeno, el fósforo, el potasio, el calcio y el magnesio, entre otros.[11][12][13][14][15] Su importancia radica en ser un indicativo de productividad ecológica, útil para predecir el ciclo de nutrientes, y entender los mecanismos de fertilización del suelo.[16] También, y debido a que la hojarasca es uno de los principales componentes de tránsito e interacción en los procesos de retroalimentación planta-suelo, su análisis resulta útil en la comprensión de las estrategias de competitividad y adaptabibilidad biogeoquímica en comunidades en torno a especies vegetales.[17][18][19]
Producción[editar]

La caída de hojarasca, así como su grosor, velocidad de descomposición y contenido de nutrientes, suele variar considerablemente,[16] y está influenciada por varios tipos de factores, correspondientes a condiciones biológicas, climáticas y geográficas.[14][16]
Factores biológicos[editar]
Entre las variables se encuentra la edad, cobertura, diversidad y hábitos de crecimiento del bosque.[15][21] Un ejemplo de esto es la composición de la hojarasca según la edad del bosque: los tejidos de las hojas representan aproximadamente el 70 % de la caída de hojarasca, pero el material leñoso tiende a aumentar con la edad del bosque.[22] La resorción (retranslocación) de nutrientes por parte de las plantas previo a la caída de hojas, es otro agente que influye sobre la calidad de los nutrientes de la hojarasca resultante,[23] y es ventajosa en suelos con poca disponibilidad de éstos, al ser otra estrategia en la conservación y reutilización de macroelementos esenciales.[23] Las sustancias redirigidas incrementan la eficiencia de la planta en el uso de los nutrientes, al poder reutilizar este contenido en otras zonas de su biomasa, usualmente novel o en crecimiento.[23] Si bien suele variar considerablemente, un 50 % es el promedio estimativo de resorción que poseen las plantas respecto del contenido de nitrógeno y fósforo que contienen las hojas y el follaje previo a la abscisión.[24] Esta variación depende de la especie y de la edad de los árboles.[25] También se ha constatado que en lugares pobres en nutrientes la resorción tiende a aumentar, lo que hace fluctuar el aporte final de elementos orgánicos en las hojas caídas.[23][26]
Factores climáticos[editar]
Entre las condicionantes ambientales se señala a la fuerza y velocidad del viento,[27] a la temperatura,[28] a la ocurrencia e intensidad de las precipitaciones,[5] así como al estrés hídrico,[29] como causas que influyen en la definición de picos máximos de caída de material vegetal al suelo.[14] Estos elementos pueden variar considerablemente de una estación a otra, especialmente en zonas templadas y boreales, de manera que la estacionalidad es un importante agente de incidencia sobre la variabilidad anual en la producción y composición de hojarasca.[30] Todos estas circunstancias son fundamentales para entender las diferentes respuestas en forma de producción de hojarasca por parte de distintos tipos de árboles según su clima: por ejemplo, la respuesta de los árboles caducifolios en su ciclo vital como adaptación a sus hábitats, en el que un patrón cíclico de estas condiciones climáticas ha derivado hacia una producción adaptativamente intensa de hojarasca, hasta perder completamente sus hojas en la estación invernal.[31] En el caso de especies perennifolias, si bien la intensidad de la caída de hojarasca es bastante menor al de las especies caducifolias, y mantiene una regularidad a lo largo del año, se ha constatado un aumento de su frecuencia durante el período estival, especialmente en climas subtropicales,[15] en tanto que, y de un modo similar, en ambientes tropicales la mayor cantidad de hojarasca cae en la última parte de la estación seca y temprano durante la estación húmeda.[32] En cualquier caso, López-Hernández et al. (2013) afirman que la producción de hojarasca tiende a ser mayor «en zonas húmedas y cálidas con suelos fértiles, mientras que disminuye en zonas secas y frías, con una baja disponibilidad de nutrientes».[15]
Factores geográficos[editar]
La latitud,[33][34] la altitud,[35][36] y la orientación de las laderas,[37][38] son condicionantes geográficas que han sido señaladas en distintos estudios. Se menciona una correlación entre la latitud y la producción de hojarasca, en específico, que la caída de este disminuye con el aumento de la latitud.[33][34] A pesar de este patrón observado, en las selvas tropicales hay una capa delgada de hojarasca debido a una rápida descomposición,[39] mientras que en los bosques boreales la tasa de descomposición es más lenta y conduce a la acumulación de una capa gruesa de este.[40] La producción primaria neta funciona inversamente a esta tendencia, lo que sugiere que la acumulación de materia orgánica es principalmente el resultado de la tasa de descomposición.[40] Dentro de las causas geográficas hay también una vinculación con la variabilidad climática tanto a microescalas como a escalas regionales.[37][36] La altitud ha sido señalada como elemento de influencia en algunas especies,[35] en el cual el gradiente térmico altitudinal es relevante;[36] y así mismo, se ha observado una variación en la acumulación de hojarasca de acuerdo a la orientación de las laderas, a lo cual pueden influir aspectos como la exposición solar, su influjo en la humedad, o la dinámica local de vientos.[37][38]
Interacción en la superficie[editar]

La caída de material vegetal, en su instante inicial, se caracteriza por restos de plantas recién separados, aún sin descomponer y fácilmente reconocibles, por especie y tipo de estructura originaria procedente.[41][42] A medida que dicho material permanece en los estratos superficiales del suelo, comienza un proceso gradual y progresivo de descomposición, determinando la existencia de tres tipos de capas, según el grado de descomposición de la materia resultante.[41] Según la Sociedad Canadiense de Ciencias del Suelo (CSSS), estas capas corresponden a:[42][Nota 1]
- Horizonte OFAO subhorizonte LCSSS: estrato orgánico caracterizado por la acumulación de material vegetal, en el cual las estructuras originarias (hojas, ramas o material leñoso) son todavía fácilmente reconocibles.[41][42]
- Horizonte OFAO subhorizonte FCSSS: estrato orgánico encontrado debajo del horizonte L, caracterizado por la acumulación de materia orgánica parcialmente descompuesta, de manera que el reconocimiento de sus estructuras originarias adquiere cierta dificultad.[41][42]
- Horizonte OFAO subhorizonte HCSSS: estrato orgánico debajo de F, caracterizado por la acumulación de materia vegetal completamente descompuesta, en su amplia mayoría indiscernible.[41][42]
El mantillo protege los agregados del suelo del impacto de las gotas de lluvia, evitando que la liberación de partículas de arcilla y limo obstruya los poros del suelo.[44] La liberación de partículas de arcilla y limo reduce la capacidad del suelo para absorber agua y acelera la erosión del suelo.[44] Además, el mantillo reduce la erosión del viento al evitar que el suelo pierda humedad, proporcionando una cubierta que evita el transporte del suelo.[44]
Descomposición[editar]
La forma y velocidad de la descomposición de la hojarasca regula la acumulación del mantillo.[39][40] Para calcular y establecer su tasa de descomposición, se evalúa la relación entre la cantidad caída de hojarasca en un espacio específico y delimitado, versus la cantidad acumulada de la misma en su suelo forestal.[5] Este proceso está determinado por los componentes químicos del mantillo, variables climátológicas, y la riqueza y diversidad de vida edáfica que efectúa el proceso de descomposición.[45][46][47]
- Componentes químicos de la hojarasca: La proporcionalidad del carbono versus la de otros minerales, principalmente la del nitrógeno, aunque también del potasio y fósforo, en la composición del residuo vegetal, determina la rapidez de descomposición del mantillo, así como la liberación de nutrientes,[48] y por tanto de la fertilidad del suelo.[49] Esta relación carbono-nitrógeno puede fluctuar de 10 a más de 50 unidades de carbono por cada unidad de nitrógeno, variando de manera importante la velocidad de la descomposición.[49] Si existe una alta presencia de nitrógeno, potasio y fósforo en la constitución química de la hojarasca, es decir, una relación carbono-nitrógeno baja, esto favorece una descomposición más rápida, y una mineralización expedita de estos componentes; mientras que una concentración alta de carbono o de lignita, es decir una relación carbono-nitrógeno alta, sugiere cierta resistencia y lentitud en el proceso de desintegración, o un proceso de inmovilización de estos fertilizantes.[5][46][47][48][50] De esta manera, la hojarasca se puede clasificar en mejorante si la concentración carbono-nitrógeno es de 10 a 25 unidades de carbono por cada unidad de nitrógeno; en acidificante o desmejorante si esta relación carbono-nitrógeno supera las 50 unidades; o en indiferente, si este ratio fluctúa entre 30 y 50.[49][51] Con base a estas concentraciones de nutrientes, se señala que las hojas de coníferas se descomponen más lento que las hojas latifoliadas,[48] mientras que las hojas perennes se descomponen más rápido que las hojas caducas.[52]
- Variables climáticas: Se hace especial mención a las variables de humedad y de temperatura, y en estos términos, se ha establecido que la máxima intensidad de desintegración acontece idealmente a la conjunción de rangos en torno a los 30 centígrados de temperatura, y entre sesenta y ochenta por ciento de humedad relativa, con un decrecimiento de la tasa a medida que nos alejamos en alguno de estos valores.[53]
- Características de la vida edáfica: Los organismos descomponedores inciden sobre la capacidad de desintegración de la materia orgánica y mineralizada de la hojarasca.[16] Se señala, por ejemplo, que la descomposición de la hojarasca es varias veces más rápida en suelos forestales que en suelos de pastizales, en correspondencia con la adaptación al carbono por parte de los microorganismos del suelo, así como al nivel de nitrógeno en éste.[16] La eficacia de esta comunidad descomponedora puede verse influida, además, por el tipo de árboles, la calidad de la hojarasca, y por las condiciones climáticas de su locación.[48]
Ciclo de nutrientes[editar]
La hojarasca juega un importante rol en el ciclo ecológico de nutrientes,[54] al conllevar dos fases esenciales: una primera etapa correspondiente a la transferencia de nutrientes en el suelo por parte de la planta, realizado a través de la hojarasca, en el cual se consigue una deposición de elementos esenciales a través de su descomposición;[48] seguido de una segunda fase donde los nutrientes insertos por la hojarasca en el suelo son químicamente procesados por la vida edáfica, hasta estar en condiciones de ser reabsorbidos de vuelta por la planta, completando así un ciclo completo con el reciclado de nutrientes.[55]
Los principales macronutrientes que son transferidos en este ciclo son el nitrógeno, el fósforo, el potasio, el calcio y el magnesio,[11][12][13][14][15] mientras, entre los microminerales se puede mencionar al cobre, el hierro, el manganeso y el zinc.[15] La hojarasca es la vía de entrada para la interconexión de nutrientes entre las plantas y el suelo, especialmente para el contenido de nitrógeno y fósforo que deposita en este último,[48] y que satisface a la vez el propio requerimiento que poseen las plantas de estos fertilizantes, puesto que más del 90% del nitrógeno y fósforo absorbidos por las plantas pueden llegar a provenir del reciclaje de nutrientes en el suelo.[23][56] Una vez en el suelo estos nutrientes pasan por un proceso de sucesivas transformaciones, en el cual se conjugan formas orgánicas a minerales, y de minerales a orgánicas de estos elementos.[50] Dependiendo del mineral tenemos lo siguiente:
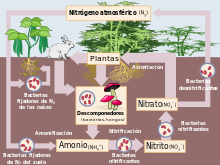
- Ciclo del nitrógeno: En el perfil de suelo el nitrógeno disuelto y parcialmente descompuesto de la hojarasca puede hallarse en forma de proteínas, aminoácidos, ácidos nucléicos y nucleótidos.[50][55] Los organismos descomponedores, usualmente bacterias y hongos, al metabolizar carbono desintegran estos compuestos hasta llevar al nitrógeno a un estado mineral, proceso llamado mineralización del nitrógeno.[50] Esta transformación puede realizarse en dos formas que son asimilables para las plantas.[50] La primera de ellas es una reorganización del nitrógeno excedente, que produce amoníaco NH
3 e ion amonio NH+
4, este último absorbible por las plantas.[55] A este proceso se le llama amonificación.[55] Seguidamente hay una etapa de nitrificación, en el que otros grupos bacterianos oxidan los dos compuestos anteriores, transformándolos primeramente en nitritos NO−
2, y tras un subsecuente proceso de oxidación culminar en la forma de nitratos NO−
3 que es la segunda forma asimilable por las plantas.[55] De ambas sustancias, las plantas volverán a extraer su nitrógeno para componer proteínas, aminoácidos, ácidos nucléicos y nucleótidos, hasta una nueva senescencia y posterior caída en forma de hojarasca, cerrando el ciclo.[55]
- Ciclo del fósforo: El fósforo orgánico del suelo está conformado en buena medida por nucleoproteínas, fosfolípidos y fosfoazúcares procedentes de residuos vegetales proporcionados por la hojarasca.[57] La mineralización del fósforo por parte de bacterias adaptadas a su metabolización conduce, luego de una sucesión de transformaciones por parte de los microorganismos del suelo, a la generación de dos compuestos que son asimilables para su reabsorción de vuelta a la planta: de manera mayoritaria se compone ion fosfato diácido H
2PO−
4, y en menor medida ion fosfato monoácido HPO2−
4.[58]
- Otras sustancias químicas: Mediante el proceso de descomposición biológica de la broza por microfauna, bacterias y hongos, se liberan adicionalmente CO
2 y H
2O, así como una sustancia orgánica relativamente resistente a la descomposición, llamada humus, que compone la mayor parte de la materia orgánica en horizontes más abajo en el perfil de suelo.[40] El potasio, el calcio y el magnesio orgánicos de la hojarasca, una vez incorporados a la dinámica bioquímica del suelo, deben tomar las formas de K+
, ion Ca2+
, e ion Mg2+
para su reabsorción por parte de las plantas.[58]
Hábitat, alimentación y competencia[editar]
La hojarasca proporciona una serie de servicios ecosistémicos, principalmente de hábitat, alimentación y refugio para diversas formas de vida. Ciertas plantas están especialmente adaptadas para germinar y prosperar en la hojarasca, entre las que se pueden contar a la Hyacinthoides non-scripta, así como algunas plantas con rizomas que también se desempeñan bien en este hábitat, como lo es por ejemplo la Oxalis acetosella.[39] También existe una diversidad de organismos que viven en el suelo del bosque y que se alimentan de los detritos vegetales producidos por la hojarasca.[39] A este grupo se le denomina detritívoros, que en conjunto con otros tipos de descomponedores habitan esta zona superficial del suelo de bosque, entre los que se pueden identificar a hongos, lombrices de tierra, bacterias, amebas, nematodos, rotíferos, tardígrados, colémbolos, oribátidos, enquitréidos, larvas de insectos, moluscos, oniscídeos y diplópodos.[39] Incluso se pueden distinguir algunas especies de microcrustáceos, especialmente de la subclase de los copépodos, que pueden vivir en hábitats húmedos de hojarasca.[59] También se han identificado importantes órdenes de insectos, compuestos principalmente por coleópteros, hemípteros e himenópteros terrestres, que completan el conjunto de macroinvertebrados que viven en estos hábitats, junto a las arañas.[60]
En el caso de la macrofauna, se pueden encontrar anfibios como los caudados y gimnofiones, que habitan el microclima húmedo debajo de las hojas caídas durante parte o la totalidad de sus ciclos de vida.[61][62] Entre los anuros también hay una considerable asimilación de los hábitats de hojarasca,[63] tal es el caso, por ejemplo, de la rana de la hojarasca o Haddadus binotatus.[64] Entre los reptiles se citan casos como el del Cricosaura typica, comúnmente conocida como largartija de la hojarasca, que habita en lugares con capas de entre 5 a 10 centímetros de hojarasca,[65][66] o el caso de varias especies del género Eutropis, que viven en los suelos forestales de selvas tropicales húmedas.[67] Algunas especies de aves, como el Seiurus aurocapilla, requieren hojarasca para alimentarse, y como material para sus nidos.[68] A veces, la hojarasca puede incluso proporcionar energía a mamíferos grandes, como ocurre en bosques boreales, donde los líquenes de la hojarasca constituyen uno de los principales alimentos en las dietas de cérvidos como el Cervus canadensis nelsoni, el Odocoileus virginianus o el Odocoileus hemionus.[69]
-
Haddadus binotatus, o rana de la hojarasca.
-
Una colonia de hongos de la especie Armillaria mellea.
-
Armadillidiidae, un ejemplar de oniscídeos.
-
Salamandra salamandra, del orden de los caudados.
-
Seiurus aurocapilla, buscando alimento entre la hojarasca.
-
Un grupo de Odocoileus virginianus entre la hojarasca.
En relación con la competencia interespecífica, se ha constatado la existencia de retroalimentaciones planta-suelo positivas, para interacciones bosque-suelo a través de la particularización de la hojarasca.[70] La composición de nutrientes de la hojarasca, así como sus modos de descomposición, determina diferentes tipos de suelo, en función de la utilidad para las especies emisoras o conductoras del deshoje, por lo general en favor del reclutamiento y/o la supervivencia de renovales de la propia especie versus la de otras especies.[19][71] En este proceso existe una alteración de la composición y estructura de las comunidades microbianas y fúngicas del suelo, las cuales dependen de la cubierta vegetal donde cae la hojarasca.[70] Al ser estas comunidades responsables de la mineralización de la materia orgánica, el efecto es un cambio en la fertilidad de esta comunidad, así como en la acidez del suelo, produciéndose un reacondicionamiento en la disponibilidad total de nutrientes, su estructura y dinámica, y repercutiendo en la adaptabilidad de las comunidades vegetacionales dependientes de la misma.[19] Potencialmente, este tipo de estrategias tienen la capacidad de alterar la composición específica de los ecosistemas forestales, e inducir una configuración determinada del sotobosque.[19]
En bosques templados y boreales, especies de coníferas con hojas reducidas en contenido de nutrientes, y cuya descomposición lenta genera un mínimo retorno mineral al sistema edáfico, son capaces de sostener suelos empobrecidos, al punto de favorecer la propagación del renoval de la especie, ya evolutivamente adaptado a estas condiciones, por sobre el renoval de otros tipos de especies.[72] En bosques caducifolios, en cambio, esta retroalimentación proviene de especies cuya hojarasca es más rica en nutrientes y más rápida en descomposición, lo cual propicia un suelo fértil, en cuyo entorno las plántulas de las especies involucradas tienen mayor capacidad de supervivencia.[73] También se ha documentado que estrategias alelopáticas a partir de hojarasca producen retroalimentaciones positivas en especies como Acacia dealbata,[74] o Eucalyptus sp,[75] que favorecen su propagación en entornos no nativos donde han sido introducidos.[74][75] De este modo, se constata que diferentes tipos de suelo, resultantes de estrategias dispares de hojarasca, han determinado modos variados de retroalimentación positiva para ciertas tipologías de especies arbóreas.[19]
Representación, uso e impacto antrópico[editar]
En el ámbito antrópico, el ser humano ha usado la hojarasca para su recreación,[76] inspiración creativa en el arte,[77] y para su provecho en huertos, viveros y en agricultura de escala doméstica.[78]
La hojarasca ha sido representada, al igual que la senescencia de las hojas, como un rasgo que culturalmente se asocia a la figura e imagen del otoño,[76] una estación del año caracterizada cotidianamente con la melancolía, la introspección y la nostalgia,[77][79] a la vez que con el bucolismo y el romanticismo,[80] y la madurez y culminación,[79] especialmente en el arte. En efecto, la pintura y la literatura tienden a representar la hojarasca como un componente sustancial en entornos y contextos bucólicos, ambientados en espacios rústicos, así como en ambientes románticos, en relación a espacios de alta carga sentimental. Un ejemplo de esto es la novela La hojarasca (1955), de Gabriel García Márquez, la cual inicia con una escena funeraria en el pueblo de Macondo, y a lo largo del relato recurrentemente surgen elementos que evocan a la nostalgia y melancolía hasta dar paso a un proceso de ensoñación.[81] Ejemplo de bucolismo en la pintura son algunos de los retratos de paisajes rurales realizados por Gustav Klimt en su estadía en Seewalchen am Attersee, donde pintó bosques de hayas y de abedules, con prominentes suelos de hojarascas, entre 1902 y 1903.[82][83] En la escultura, la hojarasca ha sido representada por Menashe Kadishman en su obra Hojas caídas (1997), exhibida en el Museo Judío de Berlín, en el cual los visitantes caminan sobre piezas metálicas con expresivos rostros humanos, recreando la sensación de caminar sobre la hojarasca.[84]
-
Hayas de Burnham, de Myles Birket Foster, s.XIX.
-
La emperatriz Eugenia y su hijo, de James Tissot, 1878.
-
Recolectadora de leña en el bosque otoñal, de Friedrich Kallmorgen, 1893.
-
Hojas cayendo, de Philip de László, 1895.
-
Hojas cayendo, de Olga Wisinger Florian, 1899.
-
Bosque de hayas, de Gustav Klimt, 1902.
-
Hojas caídas, de Menashe Kadishman, 1997.
En el marco de los usos productivos, la broza puede utilizarse como cama para el ganado o como abono.[85] El mantillo de la hojarasca se usa, en jardinería y paisajismo, con el doble propósito de ser un atributo estético, y a la vez un mejorador de las condiciones de fertilidad del suelo y del jardín,[86] mientras, esta misma cualidad es también aprovechada en la forma de tierra de hoja, una combinación de mantillo y materia orgánica parcialmente descompuesta, que se emplea especialmente en huertos, viveros y en agricultura de escala doméstica.[78] Esta última considera un creciente cuestionamiento por su extracción masiva y deliberada para su comercialización, respecto al daño que puede provocar en los ecosistemas, especialmente en lo que respecta a la disminución de nutrientes en el suelo, así como al aumento de la erosión en el bosque por escorrentía pluvial.[87] En efecto, se ha constatado un incremento de 100 veces en la erosión superficial de cultivos forestales donde se ha eliminado la hojarasca, versus la de bosques naturales y de cultivos forestales con permanencia de la hojarasca, de manera que la hojarasca cumple un importante papel en la contención de la erosión.[88][89] Al respecto, ha habido ejemplos de iniciativas normativas para la restricción y/o regulación de la extracción de tierra de hoja.[78][90] Finalmente, en el ámbito del turismo se ha hecho uso de los espacios boscosos con hojarascas, como atractivo para actividades de senderismo y excursionismo estacionales.[76]
Notas[editar]
- ↑ No se deben confundir los horizontes O y H de la clasificación de la Sociedad Canadiense de Ciencias del Suelo (CSSS), con los horizontes H y O de la clasificación de suelo realizada por la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO): la clasificación de la FAO denomina horizonte de suelo O a la capa de materia orgánica sin descomponer o en reciente descomposición, en contextos no saturados de agua, mientras que llama horizonte H cuando dicho material sí se encuentra en entornos de saturación hídrica prolongada.[43] Por su parte, la clasificación de la CSSS denomina a este último como horizonte O, caracterizado por su saturación hídrica,[42] en tanto que L, F y H corresponden a horizontes de materia orgánica sin descomponer o en reciente descomposición, en contextos moderados o bien drenados, y en ningún caso saturados.[42]
Referencias[editar]
- ↑ Santa Regina, I.; Gallardo, J.F. (1985). «Producción de hojarasca en tres bosques de la Sierra de Béjar, Salamanca». Mediterránea Ser. Biol. (8): 89-101. handle:10261/12366.
- ↑ P. Duvigneaud (1978). La síntesis ecológica. Madrid: Alhambra. p. 336.
- ↑ Núcleo Diversus (2014). «Descomponibilidad de broza». Núcleo Diversus, Centro de Investigaciones en Diversidad y Sustentabilidad. Consultado el 3 de julio de 2020.
- ↑ Proctor J., J. M. Anderson, S. C. L. Fogden, H. W. Vallack (1983). 11: Litter fall, litter standing crop and preliminary observation on herbivory. «Ecological studies in four contrasting lowland rainforests in Gunung Mulu National Park, Sarawak». J. Ecol. (en inglés) (71): 261-283. JSTOR:2259975.
- ↑ a b c d Caldato S.L., P.A. Floss, E.C. Serafini F. (2010). «Producción y descomposición de hojarasca en la selva ombrófila mixta en el sur de Brasil». Bosques (Valdivia) (31): 3-8.
- ↑ Schlatter J.; R. Grez; V. Gerding (2003). Manual para el reconocimiento de suelos. Valdivia, Chile: Universidad Austral de Chile. pp. 114 páginas. ISBN 9789567105250.
- ↑ Schlatter, J.E.; Gerding, V.; Calderón, S. (2006). «Aporte de la hojarasca al ciclo biogeoquímico en plantaciones de Eucalyptus nitens, X Región, Chile». Bosques (Valdivia) 27 (2): 115-125. doi:10.4067/S0717-92002006000200006.
- ↑ Huechacona-Ruiz, A.H. (2016). Dinámica de la producción de hojarasca y el índice de área foliar en un bosque tropical seco de Yucatán (Tesis de Postgrado en Ciencias Biológicas). Centro de Investigación Científica de Yucatán (CICY). Consultado el 5 de junio de 2020.
- ↑ Vitousek P.M., D.R. Turner, W.J. Parton, R.L. Sanford (1994). «Litter decomposition on the Mauna Loa environmental matrix, Hawaii: patterns, mechanisms, and models». Ecology (en inglés) (72): 418-429. JSTOR:1939545.
- ↑ Isaac, S.R. y Nair, M.A. (2006). «Litter dynamics of six multipurpose trees in a homegarden in Southern Kerala, India». Journal of Agroforestry System (en inglés) (67): 203-213. doi:10.1007/s10457-005-1107-3.
- ↑ a b Finér L. (1996). «Variation in the amount and quality of litterfall in a Pinus sylvestris L. stands growing on a bog». For. Ecol. Manage. (en inglés) (80): 111. doi:10.1016/0378-1127(95)03652-0.
- ↑ a b Kavvadias V. A., D. Alifragis, A. Tsiontsis, G. Brofas, G. Stamatelos (2001). «Litterfall, litter accumulation and litter decomposition rates in four forest ecosystems in northern Greece». For. Ecol. Manage. (en inglés) (144): 113-127. doi:10.1016/S0378-1127(00)00365-0.
- ↑ a b González R. H., I. Cantú S., R. G. Ramírez L., M. V. Gómez M., T. G. Domínguez G., J. Bravo G., R. K. Maiti (2008). «Spatial and seasonal litterfall deposition pattern in the Tamaulipan thornscrub, Northeastern Mexico». Intern. J. Agric. Environ. Biotechnol. (en inglés) (1): 177-181.
- ↑ a b c d Gutiérrez-Vázquez, M. H.; Méndez-González, J.; Flores-López, C.; Ramírez-Díaz, J. A.; & Gutiérrez-Vázquez, B. N. (2012). «Litterfall in Pinus greggii Engelm: And Pinus cembroides Zucc. plantations, in Coahuila, México». Revista fitotecnia mexicana 35 (2): 123-133.
- ↑ a b c d e f López-Hernández, J. M.; González-Rodríguez, H.; Ramírez-Lozano, R. G.; Cantú-Silva, I.; Gómez-Meza, M. V.; Pando-Moreno, M. & Estrada-Castillón, A. E. (2013). «Producción de hojarasca y retorno potencial de nutrientes en tres sitios del estado de Nuevo León, México». Polibotánica (35): 41-64.
- ↑ a b c d e Ochoa-Hueso, R.; Delgado-Baquerizo, M.; King, P.T.A.; Benham, M.; Arca, V.; Power, S.A. (2019). «Ecosystem type and resource quality are more important than global change drivers in regulating early stages of litter decomposition». Soil Biology and Biochemistry (en inglés) (129): 144-152. doi:10.1016/j.soilbio.2018.11.009.
- ↑ Bever, J. D. (1994). «Feeback between Plants and Their Soil Communities in an Old Field Community». Ecology (en inglés) 75 (7): 1965-1977. doi:10.2307/1941601. JSTOR 1941601.
- ↑ Bever, J. D.; Westover, K. M.; Antonovics, J. (1997). «Incorporating the Soil Community into Plant Population Dynamics: The Utility of the Feedback Approach». The Journal of Ecology. (en inglés) 85 (5): 561. doi:10.2307/2960528.
- ↑ a b c d e T. Marañón-Arana, Cr. Aponte-Perales, I. M. Pérez-Ramos, B. Ibáñez-Moreno, M. T. Domínguez-Núñez, L. Ventura-García y L. Gómez-Aparicio (2012). «Interacciones árbol-suelo y funcionamiento del bosque mediterráneo». Cuadernos de la Sociedad Española de Ciencias Forestales (35): 81-89. ISSN:1575-2410.
- ↑ Del Arco, J.M., Escudero, A., & Garrido, M.V. (1991). «Effects of site characteristics on nitrogen retranslocation from senescent leaves». Ecology (en inglés) (72): 701-708.
- ↑ Vitousek, P.M. (1982). «Nutrient cycling and nutrient use efficiency». American Naturalist (en inglés) (119): 553-572. JSTOR:2461143.
- ↑ W. M. Lonsdale (1988). «Predicting the amount of litterfall in forests of the world». Annals of Botany (en inglés) 61 (3): 319-324. doi:10.1093/oxfordjournals.aob.a087560.
- ↑ a b c d e A. Gallardo, F. Covelo, L. Morillas, M. Delgado (2009). «Ciclos de nutrientes y procesos edáficos en los ecosistemas terrestres: especificidades del caso mediterráneo y sus implicaciones para las relaciones suelo-planta». Ecosistemas 18 (2): 4-19.
- ↑ Aerts, R. (1996). «Nutrient resorption from senescing leaves of perennials: are there general patterns?». Journal of Ecology (en inglés) (84): 597-608. JSTOR:2261481.
- ↑ Eckstein, R.L.; Karlsson, P.S., Weih, M. (1999). «Leaf time span and nutrient resorption as determinants of plant nutrient conservation in temperate arctic regions». New Phytologist (en inglés) (143): 177-189. doi:10.1046/j.1469-8137.1999.00429.x.
- ↑ Pugnaire, F.I., Chapin, F.S. (1993). «Controls over nutrient resorption from leaves of evergreen mediterranean species». Ecology (en inglés) (74): 124-129. doi:10.2307/1939507.
- ↑ Huber J. A.; C. Oyarzún C. (1983). «Producción de hojarasca y sus relaciones con factores meteorológico en un bosque de Pinus radiata». Bosques (Valdivia) (Dirección de Investigación y Desarrollo, Universidad Austral de Chile) (1): 1-11. doi:10.4206/bosque.1983.v5n1-01.
- ↑ Roig S., M. del Río, I. Cañellas, G. Montero (2005). «Litterfall in Mediterranean Pinus pinaster Ait. stands under different thinning regimes». For. Ecol. Manage. (en inglés) (206): 179-190. doi:10.1016/j.foreco.2004.10.068.
- ↑ Pavón N. P., O. Briones, J. Flores R. (2005). «Litterfall production and nitrogen content in an intertropical semi-arid Mexican scrub». J. Arid Environ. (en inglés) (60): 1-13. doi:10.1016/j.jaridenv.2004.03.004.
- ↑ Doll, U.; Araya, P.; Soto-Cerda, L.; Aedo, D.; & Vizcarra, G. (2018). «Producción y composición de la hojarasca en un renoval preandino de Nothofagus glauca de la región del Maule». Bosques (Valdivia) 39 (1): 151-156. doi:10.4067/S0717-92002018000100151.
- ↑ F.J. Alcaraz-Ariza (2012). «Biomas templados». Geobotánica, Universidad de Murcia. Consultado el 6 de julio de 2012.
- ↑ A. V. Spain (1984). «Litterfall and the standing crop of litter in three tropical Australian rainforests». Journal of Ecology (en inglés) 72 (3): 947-961. JSTOR 2259543.
- ↑ a b Lousier, J.D. & Parkinson, D. (1976). «Litter decomposition in a cool temperate deciduous forest». Canadian Journal of Botany (en inglés) (54): 419-436.
- ↑ a b Mikola, P. (1960). «Comparative experiment on decomposition rates of forest litter in southern and northern Finland». Oikos (en inglés) (II): 161-166. JSTOR:3564889.
- ↑ a b Dames J., M. C. Scholes, C. J. Straker (1998). «Litter production and accumulation in Pinus patula plantations of the Mpumalanga Province, South África». Plant Soil (en inglés) (203): 183-190. JSTOR:42949866.
- ↑ a b c S. Espín-Meneses; E. Suárez (2012). Patrones altitudinales de descomposición de hojarasca en dos localidades de páramo sometidas a diferentes régimenes climáticos (Tesis de Comunicación Ambiental). Universidad San Francisco de Quito. Archivado desde el original el 12 de julio de 2020. Consultado el 8 de agosto de 2020.
- ↑ a b c Gaspar-Santos, Elsa Saraí, González-Espinosa, Mario, Ramírez-Marcial, Neptalí, & Álvarez-Solís, José David. (2015). «Acumulación y descomposición de hojarasca en bosques secundarios del sur de la Sierra Madre de Chiapas, México». Bosques (Valdivia) 36 (3): 467-480. doi:10.4067/S0717-92002015000300013.
- ↑ a b Sariyildiz T.; M. Küçkü (2008). «Litter mass in deciduous and coniferous trees in Artvin, northeast Turkey: Relationships with litter quality, microclimate, and soil characteristics». Turkish Journal of Agriculture and Forestry (en inglés) 37 (9): 547-559.
- ↑ a b c d e Packham, J.R.; Harding, D.J.L.; Hilton, G.M.; Stuttard, R.A. (1992). Functional Ecology of Woodlands and Forests (en inglés). Londres: Chapman & Hall. pp. 133-134, 246-247, 265. ISBN 041-243-950-6.
- ↑ a b c d Schlesinger, W. H. (1997). Biogeochemistry: An Analysis of Global Change (en inglés). Academic Press. pp. 108, 135, 152-158, 180-183, 191-194.
- ↑ a b c d e f University of British Columbia (2012). «Soil horizons and layers» (en inglés). Facultad de Tierra y Sistemas Alimentarios de la Universidad de Columbia Británica. Archivado desde el original el 25 de diciembre de 2012. Consultado el 29 de junio de 2020.
- ↑ a b c d e f g Sociedad Canadiense de Ciencias del Suelo (CSSS) (2020). «Horizontes del suelo». Soils of Canada (en inglés). Consultado el 13 de julio de 2021.
- ↑ Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) (1998). «Appendix 1: Soil horizon designations». World reference base for soil resources (en inglés). Roma. ISBN 92-5-104141-5.
- ↑ a b c Chanasyk, D.S.; Whitson, I.R.; Mapfumo, E.; Burke, J.M.; Prepas, E.E. (2003). «The Impacts of Forest Harvest and Wildfire on Soils and Hydrology in Temperate Forests: A Baseline to Develop Hypotheses for the Boreal Plain». Journal of Environmental Engineering and Science (en inglés) (2): S51-S62. doi:10.1139/S03-034.
- ↑ Swift M.; O. Heal; J. Anderson (1979). Decomposition in terrestrial ecosystems (en inglés). Berkeley: Studies in Ecology Nº 5, University of California Press. p. 372.
- ↑ a b F. Poggiani, M. Schumacher (2004). "Nutrient cycling in native forests", en J. Gonçalves, V. Benedetti eds. "Forest nutrition and fertilization". Piracicaba, Brasil. IPEF. p. 287-305.
- ↑ a b S. Pallardy (2008). Physiology of Woody Plants (en inglés). Academic Press, El Sevier. p. 454. ISBN 978-0120-8876-51.
- ↑ a b c d e f Bunvong Thaiutsa; Orman Granger (1979). «El clima y la descomposición de la hojarasca en el bosque tropical». Unasylva (Organización de las Naciones Unidas para la Agricultura y la Alimentación) 126 (31). Archivado desde el original el 11 de julio de 2020. Consultado el 9 de julio de 2020.
- ↑ a b c ISSN 0120-0135.
- ↑ a b c d e P. R. Solórzano-Peraza (2018). «Mineralización e inmovilización de nitrógeno en el suelo». Red Agriculturers de Especialistas en Agricultura. Consultado el 4 de julio de 2020.
- ↑ Duchaufour, P. (1987). Edafología, edafogénesis y clasificación. Barcelona, España: Editorial Masson. p. 493.
- ↑ Reis M. G. F., N. F. Barros (1990). "Ciclagem de nutrientes em plantios de eucalipto", en Barros N. F., Novais R. F. eds. "Relação solo-eucalipto". Viçosa, Brasil. Editora Folha de Viçosa. p. 265-302.
- ↑ M. Kononova (1975). Humus of virgin and cultivated soils (en inglés). Gieseking, Berlín: Soil components. pp. 475-526. doi:10.1007/978-3-642-65915-7_8.
- ↑ Araújo, V. F. P.; Barbosa, M. R. V.; Araújo, J.P.; & Vasconcellos, A. (2020). «Variação espaço-temporal da serapilheira em uma floresta tropical sazonalmente seca no Nordeste do Brasil». Brazilian Journal of Biology (en portugués) 80 (2): 273-284. doi:10.1590/1519-6984.192113.
- ↑ a b c d e f g N. Iñón (2017). «Ciclo del nitrógeno Química y Biología: 1495120476.pdf». Universidad Nacional de San Martín, Docencia de Bioquímica en Licenciatura de Biotecnología. Consultado el 4 de julio de 2020.
- ↑ Chapin, F. S.; Matson, P. A.; Mooney, H. A. (2006). Principles of terrestrial ecosystem ecology (en inglés). Nueva York: Springer. pp. 442 páginas.
- ↑ Gueçaimburu, J. M.; Vázquez, J. M.; Tancredi, F.; Reposo, G. P., Rojo, V.; Martínez, M.; & Introcaso, R. M. (2019). «Evolución del fósforo disponible a distintos niveles de compactación por tráfico agrícola en un argiudol típico». Chilean journal of agricultural & animal sciences 35 (1): 81-89. doi:10.4067/S0719-38902019005000203.
- ↑ a b A. E. Pellegrini (2017). Macronutrientes del suelo: fósforo y potasio, calcio y magnesio. Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata, año 2017. Consultado el 5 de julio de 2020.
- ↑ Fiers, F.; Jocque, M. (2013). «Leaf litter copepods from a cloud forest mountain top in Honduras (Copepoda: Cyclopidae, Canthocamptidae)». Zootaxa (en inglés) 3630 (2): 270-290. ISSN 1175-5334. PMID 26131511. doi:10.11646/zootaxa.3630.2.4.
- ↑ Barreto-García O.A., Guevara-Gutiérrez R.D., Olguín-López J.L., Mancilla-Villa O.R., Medina-Valdovinos E.K., & Murillo-Hernández J.E. (2018). «Macroinvertebrados de hojarasca y suelo en selva baja caducifolia y zonas perturbadas». Idesia (Arica) 36 (1): 105-113. doi:10.4067/S0718-34292018000100105.
- ↑ Velo-Antón, G., Buckley, D. (2015). «Salamandra salamandra (Linnaeus, 1758)». Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Martínez-Solano, I. (Eds.). Enciclopedia Virtual de Vertebrados Españoles, Museo Nacional de Ciencias Naturales de Madrid (MNCN), CSIC. Archivado desde el original el 25 de julio de 2013. Consultado el 11 de agosto de 2020.
- ↑ M.J. Benton (2014). Vertebrate Palaeontology (en inglés) (4º edición). Wiley-Blackwell. p. 103. ISBN 978-1-118-40755-4.
- ↑ R.A. Pérez-Tobar (2011). Estructura y composición de un ensamlaje de anuros en un gradiente altitudinal de montaña perturbado en la subcuenca del río de Las Piedras, Popayán, Cauca, Colombia (Maestría en Desarrollo Sostenible y Medio Ambiente). Centro de Investigaciones en Medio Ambiente y Desarrollo, Universidad de Manizales. p. 68. Archivado desde el original el 11 de julio de 2020. Consultado el 9 de julio de 2020. handle: 6789/1073.
- ↑ Coco, L.; Borges J.; Vitor N.T.; Fusinatto, L.A.; Kiefer, M.C.; Oliveira, J.C.F.; Araújo, P.G.; Costa, B.M.; Sluys, M.; & Rocha, C.F.D. (2014). «Feeding habits of the leaf litter frog Haddadus binotatus (Anura, Craugastoridae) from two Atlantic Forest areas in southeastern Brazil». Anais da Academia Brasileira de Ciências (en inglés) 86 (1): 239-249. doi:10.1590/0001-37652014113012.
- ↑ L.M. Díaz, A.R. Estrada, V. Berovides, L.V. Moreno (1997). Ecología, reproducción y conservación de la lagartija de la hojarasca Cricosaura typica (Sauria: Xantusiidae). IV Simposio de Zoología de La Habana, Instituto de Ecología y Sistemática de La Habana. p. 79.
- ↑ A. Fong, R. Viña, A. Arias (1999). «Aspectos de la Historia Natural de Cricosaura typica (Sauria: Xantusiidae) de Cuba». Caribbean Journal of Science 35 (1-2): 148-150.
- ↑ T. Chan-ard, J. Nabhitabhata, J.W.K. Parr (2015). A Field Guide to the Reptiles of Thailand (en inglés). Oxford University Press. pp. 107-110. ISBN 978-0-19-973649-2.
- ↑ Dunn, J.; Garrett, K. (1997). A field guide to Warblers of North America (en inglés). New York: Peterson Field Guides. p. 451. ISBN 0-395-78321-6.
- ↑ Richard L.W. & C. Les Marcum (2005). «Lichen litterfall consumption by wintering deer and elk in western Montana». Journal of Wildlife Management (en inglés) 69 (3): 1081-1089. JSTOR 3803347.
- ↑ a b Aponte-Perales, C. (2011). «Interacciones planta-suelo en un bosque mediterráneo». Ecosistemas 20 (2-3): 95-100.
- ↑ Ehrenfeld, J.G.; Ravit, B. & Elgersma, K. (2005). «Feedback in the plant-soil system». Annual Rev. Environ. Resour. (en inglés) (30): 75-115. doi:10.1146/annurev.energy.30.050504.144212.
- ↑ Aerts, R. (1995). «The advantages of being evergreen». Trends in Ecology and Evolution (en inglés) (10): 402-407. PMID 21237084.
- ↑ Hobbie, S. E. (1992). «Effects of plant species on nutrient cycling». Trends in Ecology and Evolution (en inglés) (7): 336-339. PMID 21236058. doi:10.1016/0169-5347(92)90126-V.
- ↑ a b P. Lorenzo & S. Rodríguez-Echeverría (2012). «Influence of soil microorganisms, allelopathy and soil origin on the establishment of the invasive Acacia dealbata». Plant Ecology & Diversity (en inglés) 5. doi:10.1080/17550874.2012.713404.
- ↑ a b F. Tererai; M. Gaertner; S. M. Jacobs; D. M. Richardson (2013). «Eucalyptus invasions in riparian forests: Effects on native vegetation community diversity, stand structure and composition». Forest Ecology and Management (en inglés) (297): 84-93. doi:10.1016/j.foreco.2013.02.016.
- ↑ a b c P. Montes (16 de septiembre de 2019). «Cuatro rutas de senderismo otoñales en Salamanca». La Gaceta de Salamanca. Consultado el 3 de julio de 2020.
- ↑ a b R. Martínez-Mir (s.f.). «El otoño, la melancolía y la producción artística]». Revista Buena Salud. Consultado el 3 de julio de 2020.
- ↑ a b c Rojas-Arévalo, F. (2009). Análisis técnico y económico de la producción de sustratos para viveros frutales: Estudio de casos (Tesis). pp. 6-7. handle/2250/112324.
- ↑ a b J. Pigem. «El otoño nos invita a la reflexión y al desapego». Revista Cuerpomente. Consultado el 3 de julio de 2020.
- ↑ A. Campos-Díez (24 de septiembre de 2015). «¿Es inevitable ponerse triste en otoño o es que nos gusta el drama?». El País. Consultado el 3 de julio de 2020.
- ↑ Araújo-Fontalvo, O.; Premat, J.; Amaya, F.; Bacca, R.; Pouliquen, H.; Rivera, O.; Delgado, J. (2015). El legado de macondo: Antología de ensayos críticos sobre Gabriel García Márquez. Editorial Universidad del Norte. doi:10.2307/j.ctt1c3q0kw.
- ↑ Galería Neue Meister (s.f.). «Buchenwald I, Gustav Klimt. Descripciones de obras» (en alemán). Consultado el 4 de julio de 2020.
- ↑ E. Ruiz (11 de octubre de 2017). «Cuando el otoño inspira al arte». Revista Condé Nast Traveler. Consultado el 4 de julio de 2020.
- ↑ D. Manor (15 de mayo de 2015). «Obituario de Menashe Kadishman». The Guardian (en inglés). Consultado el 4 de julio de 2020.
- ↑ FAO & T.J. Wormald (1995). Plantaciones forestales mixtas y puras de zonas tropicales y subtropicales. Organización de las Naciones Unidas para la Alimentación y la Agricultura. pp. 18 de 175.
- ↑ R. Loparco (4 de julio de 2020). «Local gardening: Smart mulching will protect plants». Observer-Dispatch (en inglés). Consultado el 5 de julio de 2020.
- ↑ R. Bevilacqua (25 de enero de 2018). «Cámara de Diputados aprobó proyecto de ley que prohíbe la extracción de tierra de hojas». Revista Ladera Sur. Consultado el 7 de julio de 2020.
- ↑ R. Nasi, S. Wonder, J.J. Campos A. (2002). Servicios de los ecosistemas forestales. Centro Agronómico y Tropical de Investigación y Enseñanza CATIE. p. 7. ISBN 9977-57-389-1.
- ↑ Wiersum, K.F. (1984). Strategies and Designs for Afforestation, Reforestation, and Tree Planting (en inglés). Wageningen, países Bajos: Proceedings of an International Symposium PUDOC.
- ↑ Senado de la Repúbica de Chile (29 de noviembre de 2019). «Delito de extracción de tierra de hoja: Sala del Senado aprobó ideas matrices del proyecto». Diario Constitucional de Chile. Consultado el 7 de julio de 2020.

















