Alótropos del fósforo

El fósforo elemental puede existir en varios alótropos; los más comunes de ellos son sólidos blancos y rojos. También se conocen alótropos sólidos violetas, azules y negros. El fósforo gaseoso existe como difósforo y fósforo atómico.

Fósforo blanco[editar]

El Fósforo blanco, fósforo amarillo, o simplemente tetrafósforo (P
4) existe como moléculas integradas por cuatro átomos en una estructura tetraédrica. El arsénico y antimonio gaseosos y amarillos junto con el trifosfato de arsénico (AsP
3), cada uno tiene una estructura tetraédrica similar. El arreglo tetraédrico resulta en una tensión anular e inestabilidad. La molécula es descrita como seis enlaces simples P–P. Dos distintas formas cristalinas son conocidas. La forma α, la cual es estable bajo condiciones estándar, tiene una estructura cristalina de cuerpo cúbico centrado en las caras. Se transforma de manera reversiva en la forma β a 195.2 K. La forma β se cree que tiene una estructura cristalina hexagonal.[1]
El fósforo blanco es una cera translúcida y sólida que rápidamente se convierte en amarilla cuando es expuesta a la luz. Por esta razón también es llamado fósforo amarillo. Brilla de manera verdosa en la oscuridad (cuando es expuesto a oxígeno), es altamente inflamable y pirofórico (se prende por sí solo) al contacto con el aire así como tóxico (causando un severo daño hepático si se ingiere y fosfonecrosis por ingestión crónica o inhalación). El hedor generado por la combustión de esta forma tiene un característico olor a ajo y las muestras son comúnmente cubiertas con "(di)pentóxido de fósforo" blanco, el cual consiste en P
4O
10 tetraédrico con oxígeno añadido entre los átomos de fósforo y en sus vértices. El fósforo blanco es ligeramente soluble en agua y puede ser almacenado bajo agua. De hecho, el fósforo blanco sólo está seguro de la auto ignición cuando se sumerge en agua. Es soluble en benceno, aceites, sulfuro de carbono y dicloruro de disulfuro.
Producción y aplicaciones[editar]
El alótropo blanco puede ser producido utilizando distintos métodos. En el proceso industrial, la roca de fosfato es calentada en un horno ya sea electrónico o a base de combustible en presencia de carbono y óxido de silicio (IV).[2] El fósforo elemental es posteriormente liberado como vapor y puede ser recolectado bajo ácido fosfórico. Una ecuación idealizada para esta reacción carbotérmica se muestra para el fosfato de calcio (aunque la roca de fosfato contiene cantidades significativas de fluoroapatita):
- 2 Ca
3(PO
4)
2 + 8 C → P
4 + 8 CO
2 + 6 Ca

El fósforo blanco tiene una considerable presión de vapor a temperaturas normales. La densidad de vapor indica que el vapor está compuesto de moléculas P
4 hasta los 800 °C. Por encima de esta temperatura existe disociación en moléculas de P
2.
Se enciende de manera espontánea en el aire a una temperature de 50 °C y a bajas temperaturas si se divide finamente. Esta combustión genera óxido de fósforo (V):
- P
4 + 5 O
2 → P
4O
10
Debido a esta propiedad, el fósforo blanco es utilizado como arma.
No existencia del P
8 cúbico[editar]
Aunque el fósforo blanco se convierte al alótropo rojo termodinámicamente más estable, la formación de la molécula P
8 cúbica no se observa en la fase condensada. Derivados de esta molécula hipotética se han preparado a partir de fosfaalquinos.[3]
Fósforo rojo[editar]


El fósforo rojo puede ser formado por el calentamiento de fósforo blanco a 250 °C (482 °F) o al exponer fósforo blanco a la luz del sol. El fósforo rojo existe como una red amorfa. Tras un calentamiento prologando el fósforo rojo amorfo se cristaliza. El fósforo rojo no se enciende al aire libre a temperaturas menores a 240 °C, mientras que piezas de fósforo blanco entran en ignición a 30 °C. La ignición es espontánea a temperatura ambiente con el material finamente dividido. Calentar fósforo rojo en presencia de humedad crea gas fosfano, el cual es tanto altamente inflamable como tóxico.
Fósforo violeta de Hittorf[editar]


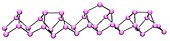
El fósforo monoclínico o fósforo violeta también es conocido como Fósforo metálico de Hittorf.[4][5] En 1865, Johann Wilhelm Hittorf calentó fósforo rojo en un tubo sellado a 530 °C. La parte superior del tubo se mantuvo a 444 °C. Grandes cristales opacos monoclínicos o romboédricos subliman. El fósforo violeta puede ser preparado al disolver fósforo blanco en plomo fundido en un tubo sellado a 500 °C por 18 horas. Bajo congelamiento lento, el alótropo de Hittorf se cristaliza. Los cristales pueden ser revelados al disolver el plomo en un diluyente de ácido nítrico seguido de un hervido en ácido clorhídrico concentrado.[6] Además, una forma fibrosa existe con cajas fosfóricas similares. Abajo se muestra una cadena de átomos de fósforo que exhiben tanto la forma fibrosa como la púrpura.
Reacciones del fósforo violeta[editar]
No entra en ignición en aire a menos que sea calentado a 300 °C y es insoluble en todos los solventes. No es atacado por alcalinos y sólo reacciona lentamente con halógenos. Puede ser oxidado por ácido nítrico en ácido fosfórico.
Si es calentado en una atmósfera de gas inerte, por ejemplo nitrógeno o dióxido de carbono se sublima y el vapor condensa a fósforo blanco. Si es calentado en una máquina de vacío y el vapor se condensa rápidamente, entonces se puede obtener fósforo violeta. Puede parecer que el fósforo violeta es un polímero de masa molecular relativamente alta, el cual al calentarse se rompe en moléculas P
2. Al ser enfriado, este normalmente dimeriza para dar lugar a moléculas P
4 (por ejemplo fósforo blanco), pero al vacío se conectan de nuevo para formar el alótropo polimérico violeta.
Fósforo negro[editar]
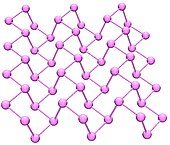

El fósforo negro es una forma termodinámicamente estable del fósforo a temperatura y presión ambiente. Se obtiene al calentar fósforo blanco a presiones altas (12,000 atmósferas). En apariencia las propiedades y estructura son como el grafito, siendo negro y hojaldrado, un conductor de electricidad y teniendo hojas plegadas de átomos conectados. Fotones, fonones y electrones en una capa de la estructura del fósforo negro se comportan de una manera altamente anisotrópica dentro del plano de las capas, exhibiendo un fuerte potencial para aplicaciones en películas delgadas electrónicas y optoelectrónicos infrarrojos.[7]
El fósforo negro tiene una estructura ortorrómbica y es el último de los alótropos reactivos: como resultado de esta red de anillos de pares de seis interconectados. Cada átomo es enlazado a otros tres átomos.[8][9] Se ha reportado una síntesis reciente de fósforo negro utilizando sales metálicas como catalizadores.[10]
Las similitudes con el grafito también incluye la posibilidad de una laminación de cinta adhesiva, resultando en fosforeno, grafeno –como un material con excelente carga- transporte de propiedades.[11][12][13]
Una de las formas del fósforo rojo/negro es un sólido cúbico.[14]
Difósforo[editar]

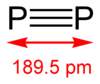
El alótropo difósforo (P
2) puede obtenerse normalmente bajo condiciones extremas (por ejemplo, del P
4 a 1100 kelvin). Sin embargo algunos avances se obtuvieron en generar una molécula diatómica en una solución homogénea bajo condiciones normales con el uso de un metal de transición complejo (basado en, por ejemplo, tungsteno y niobio).[15]
El difósforo es la forma gaseosa del fósforo y la forma termodinámicamente estable por encima de 1200 °C y hasta 2000 °C. La disociación de tetrafósforo (P
4) comienza en bajas temperaturas: el porcentaje de P
2 a 800 °C es ≈ 1%. A temperaturas por encima de los 2000 °C, la molécula de difósforo comienza a disociarse en fósforo atómico.
Nanorods de fósforo[editar]
Los Nanorods de fósforo se sintetizaron como polímeros P−
12 en dos modificaciones.[16]
La fase roja-café difiere del fósforo rojo y es también estable en el aire por semanas. Un microscopio electrónico mostró la forma roja-café con largos y paralelos nanorods con un diámetro entre 0.34 nm y 0.47 nm.
| Forma | blanco(α) | blanco(β) | violeta | negro |
|---|---|---|---|---|
| Simetría | Cúbico centrado en las caras | Triclínica | Monoclínica | Ortorrómbica |
| Símbolo Pearson | aP24 | mP84 | oS8 | |
| Grupo espacial | I43m | P1 No.2 | P2/c No.13 | Cmca No.64 |
| Densidad (g/cm³) | 1.828 | 1.88 | 2.36 | 2.69 |
| Banda prohibida (eV) | 2.1 | 1.5 | 0.34 | |
| Índice de refracción | 1.8244 | 2.6 | 2.4 |
Referencias[editar]
- ↑ Marie-Thérèse Averbuch-Pouchot, A. Durif. Topics in Phosphate Chemistry. World Scientific, 1996. ISBN 981-02-2634-9. p. 3.
- ↑ Threlfall, R.E., (1951). 100 years of Phosphorus Making: 1851–1951. Oldbury: Albright and Wilson Ltd
- ↑ Streubel, Rainer (1995). «Phosphaalkyne Cyclooligomers: From Dimers to Hexamers—First Steps on the Way to Phosphorus–Carbon Cage Compounds». Angewandte Chemie International Edition in English 34 (4): 436. doi:10.1002/anie.199504361.
- ↑ Lateral Science – Phosphorus Topics Archivado el 21 de febrero de 2009 en Wayback Machine.
- ↑ Monoclinic phosphorus formed from vapor in the presence of an alkali metal Patente USPTO n.º 4620968
- ↑ Hittorf, W. (1865). «Zur Kenntniss des Phosphors». Annalen der Physik 202 (10): 193-228. Bibcode:1865AnP...202..193H. doi:10.1002/andp.18652021002.
- ↑ Arvix.org/abs/1402.0270
- ↑ Brown, A.; Rundqvist, S. (1965). «Refinement of the crystal structure of black phosphorus». Acta Crystallographica 19 (4): 684. doi:10.1107/S0365110X65004140.
- ↑ Cartz, L.; Srinivasa, S. R.; Riedner, R. J.; Jorgensen, J. D.; Worlton, T. G. (1979). «Effect of pressure on bonding in black phosphorus». The Journal of Chemical Physics 71 (4): 1718. Bibcode:1979JChPh..71.1718C. doi:10.1063/1.438523.
- ↑ Lange, Stefan; Schmidt, Peer; Nilges, Tom (2007). «Au3SnP7@Black Phosphorus: An Easy Access to Black Phosphorus». Inorganic Chemistry 46 (10): 4028-35. PMID 17439206. doi:10.1021/ic062192q.
- ↑ Liu, Han; Neal, Adam T.; Zhu, Zhen; Luo, Zhe; Xu, Xianfan; Tománek, David; Ye, Peide D. (21 de marzo de 2014). «Phosphorene: An Unexplored 2D Semiconductor with a High Hole Mobility». ACS Nano: 140324154339003. doi:10.1021/nn501226z.
- ↑ Han Liu; A. Neal; Zhen Zhu; D. Tománek; P. Ye (16 de enero de 2014). Phosphorene: A New 2D Material with High Carrier Mobility (en inglés). doi:10.1021/nn501226z. Consultado el 30 de marzo de 2022.
- ↑ Likai Li; Yijun Yu; Guo Jun Ye; Qingqin Ge; Xuedong Ou; Hua Wu; Donglai Feng; Xian Hui Chen et al. (16 de enero de 2014). Black phosphorus field-effect transistors (en inglés). PMID 24584274. doi:10.1038/nnano.2014.35. Consultado el 30 de marzo de 2022.
- ↑ Ahuja, Rajeev (2003). «Calculated high pressure crystal structure transformations for phosphorus». Physica status solidi (b) 235 (2): 282. Bibcode:2003PSSBR.235..282A. doi:10.1002/pssb.200301569.
- ↑ Piro, Na; Figueroa, Js; Mckellar, Jt; Cummins, Cc (2006). «Triple-bond reactivity of diphosphorus molecules». Science 313 (5791): 1276-9. Bibcode:2006Sci...313.1276P. PMID 16946068. doi:10.1126/science.1129630.
- ↑ Pfitzner, A; Bräu, Mf; Zweck, J; Brunklaus, G; Eckert, H (Aug 2004). «Phosphorus nanorods – two allotropic modifications of a long-known element». Angewandte Chemie (International ed. in English) 43 (32): 4228-31. PMID 15307095. doi:10.1002/anie.200460244.
- ↑ A. Holleman, N. Wiberg (1985). «XV 2.1.3». Lehrbuch der Anorganischen Chemie (33 edición). de Gruyter. ISBN 3-11-012641-9.
- ↑ Berger, L. I. (1996). Semiconductor materials. CRC Press. p. 84. ISBN 0-8493-8912-7.
Enlaces externos[editar]
- White phosphorus
- White Phophorus at The Periodic Table of Videos (University of Nottingham)
- More about White Phosphorus (and phosphorus pentoxide) at The Periodic Table of Videos (University of Nottingham)
