Ácido peracético
| Ácido peracético | ||
|---|---|---|
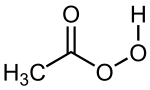 | ||
 | ||
| Nombre IUPAC | ||
| Ácido etanoperoxoico | ||
| General | ||
| Otros nombres | Ácido peroxiacético, peróxido acético, hidroperóxido de acetilo, Hidróxido de acetilo | |
| Fórmula semidesarrollada | CH3(C=O)-O-OH | |
| Fórmula estructural | Estructura en Jmol | |
| Fórmula molecular | C2H4O3 | |
| Identificadores | ||
| Número CAS | 79-21-0[1] | |
| Número RTECS | SD8750000 | |
| ChEMBL | CHEMBL444965 | |
| ChemSpider | 6336 | |
| PubChem | 6585 | |
| UNII | I6KPI2E1HD | |
| KEGG | D03467 | |
| Propiedades físicas | ||
| Apariencia | Incoloro con olor acre | |
| Densidad | 1130 kg/m³; 1,13 g/cm³ | |
| Masa molar | 76,0514 g/mol | |
| Punto de fusión | 0,1 °C (273 K) | |
| Punto de ebullición | 105 °C (378 K) | |
| Presión de vapor | 2,7 kPa | |
| Propiedades químicas | ||
| Acidez | 8.2 pKa | |
| Solubilidad en agua | 10 g/100 mL a 19 °C[2] | |
| Peligrosidad | ||
| Punto de inflamabilidad | 313,65 K (41 °C) | |
| NFPA 704 |
2
3
4
OX
| |
| Temperatura de autoignición | 473,15 K (200 °C) | |
| Frases R | R7 R10 R20/21/22 R35 R50 | |
| Frases S | (S1/2) S3/7 S14 S36/37/39 S45 S61 | |
| Riesgos | ||
| Ingestión | Dolor abdominal, sensación de quemarse, shock o colapso. Enjuagar la boca, no inducir vómito, atención médica. | |
| Inhalación | Sensación de quemarse, tos, dificultad al respirar, falta de aliento, dolor de garganta. Dar aire fresco, reposo, posición semi-incorporada, atención médica. | |
| Piel | Puede ser absorbido, enrojecimiento, dolor, ampollas, quemaduras en la piel. Enjuagar con agua abundante, remover ropas contaminadas, atención médica. | |
| Ojos | Enrojecimiento, dolor, quemaduras profundas severas. Enjuagar con agua abundante, atención médica. | |
| LD50 | 1540 mg kg-1 (oral, rata) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido peracético, también conocido como ácido peroxiacético, es un compuesto orgánico con la fórmula CH3CO3H. Este peróxido orgánico es un líquido incoloro con un olor acre característico que recuerda al del ácido acético. Puede ser altamente corrosivo.
Es un ácido mucho más débil que el ácido acético, con una pKa de 8.2.
Producción[editar]
El ácido peracético surge a partir del tratamiento de ácido acético con peróxido de hidrógeno, siendo 0.37 el valor de la constante de equilibrio a temperatura ambiente:
- H2O2 + CH3CO2H
 CH3CO3H + H2O
CH3CO3H + H2O
Como alternativa, el cloruro de etanoilo y el anhídrido acético puede ser usado para generar productos con menor contenido de agua.
El compuesto se produce alimentando de manera continua ácido acético y peróxido de hidrógeno en un medio de reacción acuoso que contiene ácido sulfúrico como catalizador. La reacción se mantiene por hasta diez días para lograr altos rendimientos de los productos de acuerdo a la siguiente ecuación.[3]
El ácido peracético siempre es vendido en disolución con ácido acético y peróxido de hidrógeno para mantener la estabilidad de la sustancia. La concentración del ácido como el ingrediente activo puede variar, y usualmente depende de su aplicación. Métodos adicionales de preparación involucran la oxidación del acetaldehído o, como una alternativa, como un producto final la reacción del anhídrido acético, peróxido de hidrógeno, y ácido sulfúrico. Otro método involucra la reacción de tetraacetiletilenodiamina (TAED) en presencia de una disolución alcalina de peróxido de hidrógeno.[3] El ácido peracético también se forma de manera natural en el medio ambiente a través de una serie de reacciones fotoquímicas que involucran formaldehído y radicales foto-oxidantes.[4]
Usos[editar]
Síntesis de otros compuestos[editar]
El principal uso del ácido peracético es para la síntesis industrial de epóxidos. Transfiere un átomo de oxígeno a dobles enlaces, por ejemplo en el etileno y el propileno, para formar epóxidos y alcoholes. Puede también ser usado para producir glicerol sintético a partir del propileno, y es usado en la fabricación del nailon.[5]
Agente antimicrobiano[editar]
El ácido peracético es un agente antimicrobiano ideal debido a su alto potencial oxidante. Es ampliamente efectivo contra microorganismos y no es desactivado ni por la catalasa ni por la peroxidasa, enzimas que sí rompen el peróxido de hidrógeno (sin. agua oxigenada). Se degrada hasta residuos seguros y respetuosos con el medio natural, como lo son el ácido acético y el peróxido de hidrógeno, y por lo tanto puede ser utilizado en aplicaciones sin enjuague. Puede ser utilizado sobre un amplio rango de temperatura (0–40 °C), en un amplio rango de pH (3.0–7.5), en procesos de limpieza en sitio (clean-in-place, CIP), en condiciones de agua dura, y no es afectado por residuos de proteína.
Mecanismo de acción[editar]
El compuesto mata microorganismos por la oxidación y subsecuente ruptura de su membrana celular, mediante el radical hidroxilo (HO·). Como la difusión es más lenta que la vida media del radical, reaccionará con cualquier compuesto oxidable en su vecindad. Puede dañar virtualmente todo tipo de macromoléculas asociadas con un microorganismo: carbohidratos, ácidos nucleicos (mutaciones), lípidos (peroxidación lipídica), y aminoácidos (por ejemplo, conversión de Phe a m-Tyr y o-Tyr). Esto lleva de manera final a la lisis celular y una verdadera muerte microbiana.
Aplicación[editar]
La Agencia de Protección Ambiental de los Estados Unidos (EPA) registró primero al ácido peracético como un antimicrobiano en 1985 para uso en interiores en superficies duras. Las recomendaciones de uso incluyen instalaciones agrícolas, establecimientos de comida, instalaciones médicas, y baños caseros. El ácido acético está registrado también para uso en plantas procesadoras de queso y lácteos, en equipo de procesamiento de alimentos, y en pasteurizadores en cervecerías, bodegas de vino, y plantas productoras de bebidas.[6] También es aplicado en la desinfección de suministros médico, para prevenir la formación de bio-películas en las industrias de papel, y como purificador de agua y desinfectante. El compuesto puede ser utilizado como un desinfectante de agua en una torre de refrigeración, donde previene la formación de películas biológicas y controla de manera efectiva a la bacteria Legionella.
Agente blanqueador[editar]
El ácido peracético puede ser utilizado como un agente blanqueador especialmente para el papel de estraza. Es usado en un pH débilmente ácido y a temperatura relativamente baja. Es un agente blanqueador relativamente eficiente y selectivo, y es ocasionalmente utilizado como una alternativa al dióxido de cloro y al cloro elemental en las secuencias de blanqueado totalmente libres de cloro (TCF). Es, sin embargo, relativamente caro, y es difícil de almacenar debido a su alta reactividad. Esto ha limitado su uso.
Desinfectante de aves[editar]
El ácido peracético es extremadamente efectivo para desinfectar canales de aves sin afectar a la piel o a la carne. En particular, el ácido se aplica a la canal, una vez desplumada y eviscerada, por inmersión o pulverización de la misma con una disolución acuosa de ácido peracético.
Seguridad[editar]
El ácido peracético es un fuerte agente oxidante (E = 1.762 V vs Ag/AgCl)[7] y un irritante primario. La exposición al ácido peracético puede causar irritación en la piel, los ojos y el sistema respiratorio, y una exposición mayor o a largo plazo puede causar daño permanente en los pulmones. Además, ha habido casos de asma ocupacional causados.[8] A pesar de que no existe un límite de exposición permisible (PEL) de la Administración de Seguridad y Salud Ocupacional (OSHA) de Estados Unidos para el ácido peracético, esto no significa que el compuesto sea inofensivo. En 2010, la Agencia de Protección Ambiental de los Estados Unidos publicó Directrices de Exposición Aguda (AEGL) para el ácido peracético.[9]
| AEGL medias ponderadas de 8 horas (TWA) | Definición | mg/m³ | ppm |
|---|---|---|---|
| 1 | La concentración a la cual la población general experimentará problemas transitorios y reversibles, tales como malestar notable, irritación, o ciertos efectos no sensoriales asintomáticos. | 0.52 | 0.17 |
| 2 | La concentración que resulta en efectos adversos a la salud irreversibles u otros efectos serios a largo plazo, o un deterioro de la habilidad para escapar. | 1.6 | 0.52 |
| 3 | La concentración que resulta en efectos a la salud que amenazan la vida, o la muerte.[10] | 4.1 | 1.3 |
En comparación, el límite de exposición permisible de la OSHA para el peróxido de hidrógeno (TWA de 8 horas) es de 1.0 ppm.[11] El ácido peracético ha encontrado un uso extendido en el cuidado de la salud, procesamiento de alimentos, y tratamiento del agua debido a sus amplias propiedades antimicrobianas. Con el fin de que los empleadores cumplan con la Cláusula de Obligación General[12] para proveer un ambiente de trabajo seguro, se recomienda que las instalaciones que utilizan disoluciones de ácido peracético empleen monitores continuos para proveer una alerta a los empleados si la concentración excede los niveles seguros. Este monitor debe ser diseñado e instalado tal que pueda automáticamente encender la ventilación adicional si es requerida.
Véase también[editar]
Referencias[editar]
- ↑ Número CAS
- ↑ (en inglés) Ficha en chemblink.com
- ↑ a b United States Department of Agriculture. Agriculture Marketing Service Peracetic acid. (PDF). Consultado el 11 de noviembre de 2006.
- ↑ U.S. National Library of Medicine. Hazardous Substances Data Bank. Consultado el 11 de noviembre de 2006.
- ↑ KEMI – Information on Substances. Peracetic Acid Archivado el 8 de enero de 2011 en Wayback Machine.. Consultado el 11 de noviembre de 2006.
- ↑ (en inglés) U.S. Environmental Protection Agency. Hydrogen Peroxide and Peroxyacetic Acid. Consultado el 11 de agosto de 2012.
- ↑ Awad, Mohamed Ismail; Denggerile, Ao; Ohsaka, Takeo (2004). «Electroreduction of Peroxyacetic Acid at Gold Electrode in Aqueous Media». Journal of the Electrochemical Society (en inglés) 151: E358. doi:10.1149/1.1812733.
- ↑ E.C. Marquand et al (2007). «Asthma Caused by Peracetic Acid-Hydrogen Peroxide Mixture». J. Occup. Health 49 (2): 155-158.
- ↑ (en inglés) peracetic acid Peracetic Acid Results. Acute Exposure Guideline Levels (AEGLs). US EPA Consultado el 13 de agosto de 2012.
- ↑ (en inglés) Definitions. Acute Exposure Guideline Levels (AEGLs). US EPA Consultado el 13 de agosto de 2012.
- ↑ 29 CFR 1910.1000 Tabla Z-1
- ↑ US – Occupational Safety and Health Act (1970), sec. 5
Bibliografía[editar]
- Patnaik, Pradyot (2007). John Wiley & Sons, ed. A Comprehensive Guide to the Hazardous Properties of Chemical Substances (en inglés). Ilustrada (3a edición). pp. 128-130. ISBN 9780471714583. Consultado el 14 de agosto de 2012.
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Ácido peracético.
Wikimedia Commons alberga una categoría multimedia sobre Ácido peracético.- (en inglés) Ficha en inchem.org
- (en inglés) Ficha en sciencelab.com
- Esta obra contiene una traducción derivada de «Peracetic acid» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.


