Transposición de Brook
La transposición de Brook es una reacción química orgánica de transposición en la cual un grupo organosililo cambia de posición con un protón hidroxílico sobre un enlace covalente de carbono a oxígeno con catálisis básica. El producto de reacción es un silil éter. Se nombró en honor al químico canadiense Adrian Gibbs Brook (1924-2013)..[1]
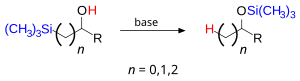
Los sustituyentes sililo pueden ser alifáticos (metilo) o aromáticos (fenilo) y el alcohol puede ser secundario o terciario con grupos alifáticos o aromáticos. La base puede ser una amina, hidróxido de sodio, un reactivo de organolitio o una aleación de un metal alcalino tal como sodio/potasio. Cuando el reactivo es un sililmetanol, la reacción procede en las posiciones 1,2 y forma metil silil éteres.
Mecanismo[editar]
El mecanismo de reacción para esta transposición inicia con la abstracción del protón del grupo hidroxilo por la base para formar el anión alcóxido. Este nucleófilo ataca al átomo de silicio en una sustitución nucleofílica intramolecular con el grupo metileno como el grupo saliente. El estado de transición propuesto para esta etapa de reacción es un anillo de tres miembros con el grado de formación de enlaces Si-O concertado con la ruptura de enlaces Si-C. El par de electrones adicional se transfiere ahora del oxígeno a un carbanión que rápidamente abstrae un protón de una fuente de protones, tal como el disolvente, para formar el éter silílico final.

Cuando el reactivo es (trifenilsilil)metilfenilmetanol, se encuentra que la energía de activación es relativamente baja, pero que la entropía de activación tiene un gran valor negativo que soporta la estructura del estado de transición cíclico. Los resultados de Hammett para un grupo de fenilmetanoles para-sustituidos confirman que los grupos electroatractores ayudan a estabilizar la carga negativa acumulada en el intermediario carbaniónico.
La fuerza motriz termodinámica para esta reacción es la formación de un enlace de oxígeno de silicio. La división del enlace Si-C y los costes del enlace O-H en términos de energía de disociación de enlace son 451 + 427 = 878 kJ / mol y las ganancias son 809 (Si-O) + 338 (C-H) = 1147 kJ / mol.
Durante la transposición se retiene la configuración de acuerdo a la inversión de Walden:

El enantiómero (+) - hidruro de sililo reacciona con cloro al cloruro de sililo correspondiente con retención del estereocentro. El posterior desplazamiento nucleofílico del cloro con difenilmetil litio ocurre con la inversión. Los siguientes dos pasos convierten el grupo difenilmetino a través de bromación con NBS (o N-bromosuccinimida) e hidrólisis con acetato de plata en un grupo difenilmetanol sin ningún cambio en la configuración. La posterior transposición de Brook al éter de sililo y la reducción con hidruro de litio y aluminio se producen con retención de modo que el producto de reacción final es el enantiómero opuesto del material de partida con signo opuesto para rotación específica.
Los acilsilanos también pueden llevar a cabo la reacción[2] y también son posibles las reacciones reversas con ciertos silil éteres[3][4]
Referencias[editar]
- ↑ A. G. Brook (1974). «Molecular rearrangements of organosilicon compounds». Acc. Chem. Res. 7 (3): 77-84. doi:10.1021/ar50075a003.
- ↑ Patrocinio, Amauri F. and Moran, Paulo J. S. Acylsilanes and their applications in organic chemistry. J. Braz. Chem. Soc., 2001, vol.12, no.1, p.07-31. ISSN 0103-5053. Online article
- ↑ Stereochemistry of the cyclization of 4-(t-butyldimethyl)siloxy-5-hexenyllithium: cis-selective ring-closure accompanied by retro-[1,4]-Brook rearrangement William F. Bailey and Xinglong Jiang Arkivoc 2005 (vi) 25-32 Online article
- ↑ Higashiya, Seiichiro; Chung, Woo Jin; Lim, Dong Sung; Ngo, Silvana C.; Kelly, William H. IV; Toscano, Paul J.; Welch, John T. (2004). «Synthesis of Mono- and Difluoroacetyltrialkylsilanes and the Corresponding Enol Silyl Ethers». J. Org. Chem. 69 (19): 6323-6328. doi:10.1021/jo049551o. Consultado el 13 de julio de 2015.
