Diferencia entre revisiones de «Galactoquinasa»
m Robot: Cambiada la plantilla: Proteína |
Sin resumen de edición |
||
| Línea 37: | Línea 37: | ||
|LocusSupplementaryData= |
|LocusSupplementaryData= |
||
}} |
}} |
||
La ''' |
La '''galactoquinasa''' ([[Número EC|EC]] 2.7.1.6) es una enzima fosfotransferasa que cataliza la [[fosforilación]] de la D-[[galactosa]] a D-[[galactosa-1-fosfato]] utilizando [[adenosín trifosfato|ATP]] como donante del grupo fosfato.<ref name=expasy>{{cita web |url=http://enzyme.expasy.org/EC/2.7.1.6 |título=ENZYME entry: EC 2.7.1.6 |fechaacceso=20 de noviembre|añoacceso=2011|autor= |fecha= |obra= |idioma= |cita= }}</ref> |
||
La [[mutación]] o ausencia de esta enzima es la causante de una de las variantes de la [[patología]] denominada [[galactosemia]], lo que impide que la galactosa sea metabolizada y por ello, se acumule en [[sangre]] y aparezca en [[orina]]. Si no se trata, puede dar lugar a la aparición de [[cataratas]] a edades muy tempranas. El tratamiento más efectivo es eliminar de la dieta la [[lactosa]]. |
|||
: '''D-galactosa + ATP <math>\rightleftharpoons</math> α-D-galactosa-1-fosfato + ADP''' |
|||
La galactoquinasa cataliza la segunda etapa de la ruta de Leloir, una ruta metabólica encontrada en muchos organismos para el catabolismo de la β-D-galactosa a glucosa-1-fosfato.<ref name= "l" /> Fue aislada por primera vez del hígado de mamíferos pero ha sido estudiada extensivamente en las levaduras,<ref name="c1" /><ref name="c2" /> archaeas,<ref>{{cite journal|last=Hartley A, Glynn SE, Barynin V, Baker PJ, et al|title=Substrate specificity and mechanism from the structure of Pyrococcus furiosus galactokinase|journal=J Mol Biol|year=2004|month=Mar|volume=337|issue=2|pages=387–98|pmid = 15003454| doi = 10.1016/j.jmb.2004.01.043|first1=Andrew|last2=Glynn|first2=Steven E.|last3=Barynin|first3=Vladimir|last4=Baker|first4=Patrick J.|last5=Sedelnikova|first5=Svetlana E.|last6=Verhees|first6=Corné|last7=De Geus|first7=Daniel|last8=Van Der Oost|first8=John|last9=Timson|first9=David J.}}</ref> plantas<ref>{{cite journal|last=Foglietti MJ, Percheron F|title=Purification and mechanism of action of a plant galactokinase|journal=Biochimie|year=1976|volume=58|issue=5|pages=499–504|pmid = 182286|first1=MJ|last2=Percheron|first2=F}}</ref><ref>{{cite journal|last=Dey PM|title=Galactokinase of Vicia faba seeds|journal=Eur J Biochem|year=1983|month=Oct|volume=136|issue=1|pages=155–9|pmid = 6617655|doi=10.1111/j.1432-1033.1983.tb07720.x|first1=PM}}</ref> y humanos.<ref name="holden04">{{cite journal|last=Holden HM, Thoden JB, Timson DJ, Reece RJ|title=Galactokinase: structure, function and role in type II galactosemia|journal=Cell Mol Life Sci|year=2004|month=Oct|volume=61|issue=19–20|pages=2471–84|pmid = 15526155| doi = 10.1007/s00018-004-4160-6|first1=H. M.|last2=Thoden|first2=J. B.|last3=Timson|first3=D. J.|last4=Reece|first4=R. J.}}</ref><ref name="meg" /> |
|||
== Isozimas == |
|||
En el ser humano existen dos genes que codifican galactoquinasas. |
|||
* El gen GALK1 codifica la galactoquinasa 1. |
|||
* El gen GALK2 codifica la [[N-acetilgalactosamina kinasa]]. Esta enzima actúa como una galactoquinasa cuando la galactosa está presente en altas concentraciones.<ref name=uniprot2>{{cita web |url=http://www.uniprot.org/uniprot/Q01415 |título=N-acetylgalactosamine kinase |fechaacceso=20 de noviembre|añoacceso=2011|autor= |fecha= |obra= |idioma= |cita= }}</ref> |
|||
== Estructura == |
|||
La galactoquinasa está compuesta por dos dominios separados por un gran hueco. Las dos regiones son conocidas como los dominios N- y C-terminal. El anillo adenina del ATP se une en un agujero hidrofóbico localizado en la interface entre los dos dominios. El dominio N-terminal está compuesto por 5 filamentos formados de láminas beta y 5 hélices alfa. El dominio C-terminal está caracterizado por dos capas de láminas beta antiparalelas y 6 hélices alfa.<ref name="holden04" /> La galactoquinasa no pertenece a la familia de las quinasas que actúan sobre carbohidratos, pero sí a la superfamilia de enzimas dependiente del ATP conocida como superfamilia GHMP quinasas.<ref>{{cite journal|last=Tang M, Wierenga K, Elsas LJ, Lai K|journal=Chem Biol Interact|year=2010|month=Dec|volume=188|issue=3|pages=376–85|pmid = 20696150|doi = 10.1016/j.cbi.2010.07.025|title=Molecular and biochemical characterization of human galactokinase and its small molecule inhibitors|first1=M.|last2=Wierenga|first2=K.|last3=Elsas|first3=L.J.|last4=Lai|first4=K.|pmc=2980576}}</ref> GHMP es una abreviatura referente a los miembros originales de la familia: galactoquinasa, [[homoserina kinasa]], [[mevalonato kinasa]] y [[fosfomevalonato kinasa]]. Los miembros pertenecientes a la superfamilia GHMP tienen una gran similitud en su estructura tridimensional aunque solamente comparten entre un 10% y 20% de su secuencia. Estas enzimas contienen tres motivos bien conservados (I, II y III), el segundo participa en la unión del nucleótido y tiene la secuencia Pro-X-X-X-Gly-Leu-X-Ser-Ser-Ala.<ref name="thoden">{{cite journal|last=Thoden JB, Holden HM|title=Molecular structure of galactokinase|journal=J Biol Chem|year=2003|month=Aug|volume=278|issue=35|pages=33305–11|pmid = 12796487| doi = 10.1074/jbc.M304789200|first1=J. B.|last2=Holden|first2=HM}}</ref> |
|||
== Especificidad == |
|||
En diferentes especies, las galactoquinasas presentan una gran variedad de especificidad de sustrato. |
|||
* La galactoquinasa de la Escherichia Coli puede fosforilar 2-deoxi-D-galactosa, 2-amino-deoxi-D-galactosa, 3-deoxi-D-galactosa y fucosa. La enzima no puede tolerar ninguna modificación en el carbono 4 (C-4) de la galactosa, pero los cambios en el C-2 no interfieren con la función de la enzima.<ref>{{cite journal|last=Yang J, Fu X, Jia Q, Shen J, et al|title=Studies on the substrate specificity of ''Escherichia coli'' galactokinase|journal=Org Lett|year=2003|month=Jun|volume=5|issue=13|pages=2223–6|pmid = 12816414| doi = 10.1021/ol034642d|first1=Jie|last2=Fu|first2=Xun|last3=Jia|first3=Qiang|last4=Shen|first4=Jie|last5=Biggins|first5=John B.|last6=Jiang|first6=Jiqing|last7=Zhao|first7=Jingjing|last8=Schmidt|first8=Joshua J.|last9=Wang|first9=Peng G.}}</ref> |
|||
* Las galactoquinasas de los humanos y ratas también son capaces de fosforilar la 2-deoxi-D-galactosa.<ref>{{cite journal|last=Timson DJ, Reece RJ|title=Sugar recognition by human galactokinase|journal=BMC Biochem|year=2003|month=Nov|volume=4|pmid = 14596685| doi = 10.1186/1471-2091-4-16|first1=David J|last2=Reece|first2=Richard J|pages=16|pmc=280648}}</ref><ref>{{cite journal|last=Walker DG, Khan HH|title=Some properties of galactokinase in developing rat liver|journal=Biochem J|year=1968|month=Jun|volume=108|issue=2|pages=169–75|pmid = 5665881|first1=DG|last2=Khan|first2=HH|pmc=1198790}}</ref> |
|||
* La galactoquinasa de la Saccharomyces cerevisiae contrariamente es altamente específica por la D-galactosa y no puede fosforilar glucosa, manosa, arabinosa, fucosa, lactosa, galactitol o 2-deoxi-D-galactosa.<ref name="c1">{{cite journal|last=Schell MA, Wilson DB|title=Purification of galactokinase mRNA from ''Saccharomyces cerevisiae'' by indirect immunoprecipitation|journal=J Biol Chem|year=1979|month=May|volume=254|issue=9|pages=3531–6|pmid = 107173|first1=MA|last2=Wilson|first2=DB}}</ref><ref name="c2">{{cite journal|last=Sellick CA, Reece RJ|title=Contribution of Amino Acid Side Chains to Sugar Binding Specificity in a Galactokinase, Gal1p, and a TranscriptionalInducer, Gal3p|journal=J Biol Chem|year=2006|month=Jun|volume=281|issue=25|pages=17150–5|pmid = 16603548| doi = 10.1074/jbc.M602086200|first1=C. A.|last2=Reece|first2=RJ}}</ref> |
|||
Por otra parte, las propiedades cinéticas de la galactoquinasa también difieren en las diferentes especies.<ref name="holden04" /> |
|||
== Mecanismo == |
|||
Recientemente se han aclarado los roles de los aminoácidos del sitio activo de la galactoquinasa humana. Asp-186 extrae un protón del C1-OH de la α-D-galactosa y el [[alcóxido]] nucleófilo resultante ataca el γ-fosfato del ATP. Un grupo fosfato es transferido al azúcar y el Asp-186 es deprotonado por agua. El cercano Arg-37 estabiliza a Asp-186 en su forma aniónica y se ha provado que es esencial para la función de la galactoquinasa mediante experimentos de mutaciones puntuales.<ref name="meg">{{cite journal|last=Megarity CF, Huang M, Warnock C, Timson DJ|title=The role of the active site residues in human galactokinase: Implications for the mechanisms of GHMP kinases|journal=Cell Mol Life Sci|year=2011|month=Mar|pmid = | doi = 10.1016/j.bioorg.2011.03.001|first1=Clare F.|last2=Huang|first2=Meilan|last3=Warnock|first3=Claire|last4=Timson|first4=David J.|volume=39|issue=3|pages=120–126}}</ref> Los residuos Asp y Arg del sitio activo están altamente conservado en las galactoquinasas.<ref name="holden04" /> |
|||
[[Image: Galactokinase_mechanism1.png|thumb|none|500px| Mecanismo de la galactoquinasa.<ref name="meg" /> El residuo aspartato es estabilizado en su forma aniónica por un residuo arginina cercano.]] |
|||
[[File:Galactokinase_crystal_structure.png|thumb|right| Estructura cristalina del sitio activo de la galactoquinasa del [[Lactococcus lactis]].<ref name="thoden" /> La galactoquinasa se muestra en verde, el fosfato en naranja y los residuos responsables de la unión del azúcar a la enzina en magenta: Arg-36, Glu-42, Asp-45, Asp-183 y Tyr-233. Arg-36 y Asp-183 de la galactoquinasa del ''Lactococcus lactis'' son análogos a los residuos Arg-37 y Asp-186 de la galactoquinasa humana.(From {{PDB|1PIE}})]] |
|||
== Función biológica == |
|||
La ruta de Leloir cataliza la conversión de galactosa en glucosa. La galactosa se encuentra en los productos lácteos, frutas y vegetales, y puede ser producida de forma endógena por la rotura de las glicoproteínas y glicolípidos. En la ruta de Leloir participan tres enzimas: galactoquinasa, [[galactosa-1-fosfato uridiltransferasa]] y [[UDP-galactosa 4-epimerasa]]. La galactoquinasa cataliza la primera etapa del metabolismo de la galactosa formando galactosa-1-fosfato.<ref name= "l" /><ref>{{cite journal|last=Holden HM, Rayment I, Thoden JB|title=Structure and function of enzymes of the Leloir pathway for galactose metabolism|journal=J Biol Chem|year=2003|month=Nov|volume=278|issue=45|pages=43885–8|pmid = 12923184| doi = 10.1074/jbc.R300025200|first1=H. M.|last2=Rayment|first2=I|last3=Thoden|first3=JB}}</ref> |
|||
== Relevancia clínica == |
|||
La galactosemia es un desorden metabólico raro caracterizado por la capacidad reducida de metabolizar galactosa y puede ser producido por una mutación en cualquiera de las tres enzimas de la ruta de Leloir.<ref name= "l">{{cite journal|last=Frey PA|title=The Leloir pathway: a mechanistic imperative for three enzymes to change the stereochemical configuration of a single carbon in galactose|journal=FASEB J|year=1996|month=Mar|volume=10|issue=4|pages=461–70|pmid = 8647345|first1=PA}}</ref> La deficiencia en galactoquinasa, también conocida como galactosemia tipo II, es un desorden metabólico recesivo causado por una mutación en la galactoquinasa humana. Alrededor de unas 20 mutaciones que causan galactosemia tipo II han sido identificadas. El principal síntoma es la aparición de cataratas a una edad temprana. En las células del cristalino del ojo humano, la [[aldehído reductasa]] convierte galactosa a galactitol. Como la galactosa no es catabolizada a glucosa debido a una mutación en la galactoquinasa, el galactitol se acumula. El gradiente de galactitol a través de la membrana de las células del cristalino provoca que entre agua en las células provocando que se hinchen y una eventual apoptosis de las células.<ref>{{cite journal|last=Timson DJ, Reece RJ|title=Functional analysis of disease-causing mutations in human galactokinase|journal=Eur J Biochem|year=2003|month=Apr|volume=270|issue=8|pages=1767–74|pmid = 12694189 |
|||
| doi = 10.1046/j.1432-1033.2003.03538.x|first1=David J.|last2=Reece|first2=Richard J.}}</ref> El tratamiento más efectivo para la galactosemia es eliminar de la dieta la lactosa. |
|||
== Enlaces externos == |
== Enlaces externos == |
||
* [http://www.nlm.nih.gov/cgi/mesh/2008/MB_cgi?mode=&term=Galactokinase MeSH Descriptor Data] |
* [http://www.nlm.nih.gov/cgi/mesh/2008/MB_cgi?mode=&term=Galactokinase MeSH Descriptor Data] |
||
== Referencias == |
|||
| ⚫ | |||
[[Categoría:Genes del cromosoma 17]] |
|||
{{listaref}} |
|||
| ⚫ | |||
[[de:Galactokinase]] |
[[de:Galactokinase]] |
||
Revisión del 16:40 20 nov 2011
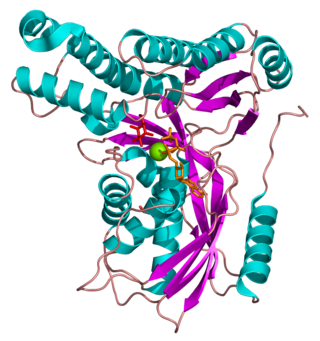
| galactoquinasa 1 | ||||
|---|---|---|---|---|
 | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolos | GALK1 (HGNC: 4118) GALK | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.7.1.6 | |||
| Locus | Cr. 17 q23-q25 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| galactoquinasa 2 | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolo | GALK2 (HGNC: 4119) | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.7.1.6 | |||
| Locus | Cr. 15 [3] | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
La galactoquinasa (EC 2.7.1.6) es una enzima fosfotransferasa que cataliza la fosforilación de la D-galactosa a D-galactosa-1-fosfato utilizando ATP como donante del grupo fosfato.[1]
- D-galactosa + ATP α-D-galactosa-1-fosfato + ADP
La galactoquinasa cataliza la segunda etapa de la ruta de Leloir, una ruta metabólica encontrada en muchos organismos para el catabolismo de la β-D-galactosa a glucosa-1-fosfato.[2] Fue aislada por primera vez del hígado de mamíferos pero ha sido estudiada extensivamente en las levaduras,[3][4] archaeas,[5] plantas[6][7] y humanos.[8][9]
Isozimas
En el ser humano existen dos genes que codifican galactoquinasas.
- El gen GALK1 codifica la galactoquinasa 1.
- El gen GALK2 codifica la N-acetilgalactosamina kinasa. Esta enzima actúa como una galactoquinasa cuando la galactosa está presente en altas concentraciones.[10]
Estructura
La galactoquinasa está compuesta por dos dominios separados por un gran hueco. Las dos regiones son conocidas como los dominios N- y C-terminal. El anillo adenina del ATP se une en un agujero hidrofóbico localizado en la interface entre los dos dominios. El dominio N-terminal está compuesto por 5 filamentos formados de láminas beta y 5 hélices alfa. El dominio C-terminal está caracterizado por dos capas de láminas beta antiparalelas y 6 hélices alfa.[8] La galactoquinasa no pertenece a la familia de las quinasas que actúan sobre carbohidratos, pero sí a la superfamilia de enzimas dependiente del ATP conocida como superfamilia GHMP quinasas.[11] GHMP es una abreviatura referente a los miembros originales de la familia: galactoquinasa, homoserina kinasa, mevalonato kinasa y fosfomevalonato kinasa. Los miembros pertenecientes a la superfamilia GHMP tienen una gran similitud en su estructura tridimensional aunque solamente comparten entre un 10% y 20% de su secuencia. Estas enzimas contienen tres motivos bien conservados (I, II y III), el segundo participa en la unión del nucleótido y tiene la secuencia Pro-X-X-X-Gly-Leu-X-Ser-Ser-Ala.[12]
Especificidad
En diferentes especies, las galactoquinasas presentan una gran variedad de especificidad de sustrato.
- La galactoquinasa de la Escherichia Coli puede fosforilar 2-deoxi-D-galactosa, 2-amino-deoxi-D-galactosa, 3-deoxi-D-galactosa y fucosa. La enzima no puede tolerar ninguna modificación en el carbono 4 (C-4) de la galactosa, pero los cambios en el C-2 no interfieren con la función de la enzima.[13]
- Las galactoquinasas de los humanos y ratas también son capaces de fosforilar la 2-deoxi-D-galactosa.[14][15]
- La galactoquinasa de la Saccharomyces cerevisiae contrariamente es altamente específica por la D-galactosa y no puede fosforilar glucosa, manosa, arabinosa, fucosa, lactosa, galactitol o 2-deoxi-D-galactosa.[3][4]
Por otra parte, las propiedades cinéticas de la galactoquinasa también difieren en las diferentes especies.[8]
Mecanismo
Recientemente se han aclarado los roles de los aminoácidos del sitio activo de la galactoquinasa humana. Asp-186 extrae un protón del C1-OH de la α-D-galactosa y el alcóxido nucleófilo resultante ataca el γ-fosfato del ATP. Un grupo fosfato es transferido al azúcar y el Asp-186 es deprotonado por agua. El cercano Arg-37 estabiliza a Asp-186 en su forma aniónica y se ha provado que es esencial para la función de la galactoquinasa mediante experimentos de mutaciones puntuales.[9] Los residuos Asp y Arg del sitio activo están altamente conservado en las galactoquinasas.[8]


Función biológica
La ruta de Leloir cataliza la conversión de galactosa en glucosa. La galactosa se encuentra en los productos lácteos, frutas y vegetales, y puede ser producida de forma endógena por la rotura de las glicoproteínas y glicolípidos. En la ruta de Leloir participan tres enzimas: galactoquinasa, galactosa-1-fosfato uridiltransferasa y UDP-galactosa 4-epimerasa. La galactoquinasa cataliza la primera etapa del metabolismo de la galactosa formando galactosa-1-fosfato.[2][16]
Relevancia clínica
La galactosemia es un desorden metabólico raro caracterizado por la capacidad reducida de metabolizar galactosa y puede ser producido por una mutación en cualquiera de las tres enzimas de la ruta de Leloir.[2] La deficiencia en galactoquinasa, también conocida como galactosemia tipo II, es un desorden metabólico recesivo causado por una mutación en la galactoquinasa humana. Alrededor de unas 20 mutaciones que causan galactosemia tipo II han sido identificadas. El principal síntoma es la aparición de cataratas a una edad temprana. En las células del cristalino del ojo humano, la aldehído reductasa convierte galactosa a galactitol. Como la galactosa no es catabolizada a glucosa debido a una mutación en la galactoquinasa, el galactitol se acumula. El gradiente de galactitol a través de la membrana de las células del cristalino provoca que entre agua en las células provocando que se hinchen y una eventual apoptosis de las células.[17] El tratamiento más efectivo para la galactosemia es eliminar de la dieta la lactosa.
Enlaces externos
Referencias
- ↑ «ENZYME entry: EC 2.7.1.6». Consultado el 20 de noviembre de 2011.
- ↑ a b c Frey PA, PA (Mar de 1996). «The Leloir pathway: a mechanistic imperative for three enzymes to change the stereochemical configuration of a single carbon in galactose». FASEB J 10 (4): 461-70. PMID 8647345.
- ↑ a b Schell MA, Wilson DB, MA; Wilson, DB (May de 1979). «Purification of galactokinase mRNA from Saccharomyces cerevisiae by indirect immunoprecipitation». J Biol Chem 254 (9): 3531-6. PMID 107173.
- ↑ a b Sellick CA, Reece RJ, C. A.; Reece, RJ (Jun de 2006). «Contribution of Amino Acid Side Chains to Sugar Binding Specificity in a Galactokinase, Gal1p, and a TranscriptionalInducer, Gal3p». J Biol Chem 281 (25): 17150-5. PMID 16603548. doi:10.1074/jbc.M602086200.
- ↑ Hartley A, Glynn SE, Barynin V, Baker PJ, et al, Andrew; Glynn, Steven E.; Barynin, Vladimir; Baker, Patrick J.; Sedelnikova, Svetlana E.; Verhees, Corné; De Geus, Daniel; Van Der Oost, John et al. (Mar de 2004). «Substrate specificity and mechanism from the structure of Pyrococcus furiosus galactokinase». J Mol Biol 337 (2): 387-98. PMID 15003454. doi:10.1016/j.jmb.2004.01.043.
- ↑ Foglietti MJ, Percheron F, MJ; Percheron, F (1976). «Purification and mechanism of action of a plant galactokinase». Biochimie 58 (5): 499-504. PMID 182286.
- ↑ Dey PM, PM (Oct de 1983). «Galactokinase of Vicia faba seeds». Eur J Biochem 136 (1): 155-9. PMID 6617655. doi:10.1111/j.1432-1033.1983.tb07720.x.
- ↑ a b c d Holden HM, Thoden JB, Timson DJ, Reece RJ, H. M.; Thoden, J. B.; Timson, D. J.; Reece, R. J. (Oct de 2004). «Galactokinase: structure, function and role in type II galactosemia». Cell Mol Life Sci 61 (19–20): 2471-84. PMID 15526155. doi:10.1007/s00018-004-4160-6.
- ↑ a b c Megarity CF, Huang M, Warnock C, Timson DJ, Clare F.; Huang, Meilan; Warnock, Claire; Timson, David J. (Mar de 2011). «The role of the active site residues in human galactokinase: Implications for the mechanisms of GHMP kinases». Cell Mol Life Sci 39 (3): 120-126. doi:10.1016/j.bioorg.2011.03.001.
- ↑ «N-acetylgalactosamine kinase». Consultado el 20 de noviembre de 2011.
- ↑ Tang M, Wierenga K, Elsas LJ, Lai K, M.; Wierenga, K.; Elsas, L.J.; Lai, K. (Dec de 2010). «Molecular and biochemical characterization of human galactokinase and its small molecule inhibitors». Chem Biol Interact 188 (3): 376-85. PMC 2980576. PMID 20696150. doi:10.1016/j.cbi.2010.07.025.
- ↑ a b Thoden JB, Holden HM, J. B.; Holden, HM (Aug de 2003). «Molecular structure of galactokinase». J Biol Chem 278 (35): 33305-11. PMID 12796487. doi:10.1074/jbc.M304789200.
- ↑ Yang J, Fu X, Jia Q, Shen J, et al, Jie; Fu, Xun; Jia, Qiang; Shen, Jie; Biggins, John B.; Jiang, Jiqing; Zhao, Jingjing; Schmidt, Joshua J. et al. (Jun de 2003). «Studies on the substrate specificity of Escherichia coli galactokinase». Org Lett 5 (13): 2223-6. PMID 12816414. doi:10.1021/ol034642d.
- ↑ Timson DJ, Reece RJ, David J; Reece, Richard J (Nov de 2003). «Sugar recognition by human galactokinase». BMC Biochem 4: 16. PMC 280648. PMID 14596685. doi:10.1186/1471-2091-4-16.
- ↑ Walker DG, Khan HH, DG; Khan, HH (Jun de 1968). «Some properties of galactokinase in developing rat liver». Biochem J 108 (2): 169-75. PMC 1198790. PMID 5665881.
- ↑ Holden HM, Rayment I, Thoden JB, H. M.; Rayment, I; Thoden, JB (Nov de 2003). «Structure and function of enzymes of the Leloir pathway for galactose metabolism». J Biol Chem 278 (45): 43885-8. PMID 12923184. doi:10.1074/jbc.R300025200.
- ↑ Timson DJ, Reece RJ, David J.; Reece, Richard J. (Apr de 2003). «Functional analysis of disease-causing mutations in human galactokinase». Eur J Biochem 270 (8): 1767-74. PMID 12694189. doi:10.1046/j.1432-1033.2003.03538.x.

