Imagen molecular
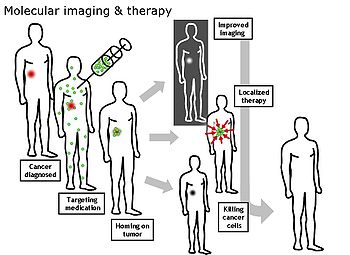
Las imágenes moleculares son la formación de imágenes a nivel molecular que se origina del campo de la radio-farmacología debido a la necesidad de un mejor entendimiento de los caminos (o trayectorias) moleculares fundamentales en los organismos de una manera no invasiva.
General[editar]
La formación de imágenes a nivel molecular se genera al principio del siglo 21 como una disciplina entre la Biología molecular y la formación de imágenes in vivo. Permite la visualización de la función celular y el seguimiento de los procesos moleculares en organismos vivos sin perturbarlos. Las diversas posibilidades en este campo son aplicables al diagnóstico de enfermedades como el Cáncer, enfermedades neurológicas y cardiovasculares. Esta técnica mejora el diagnóstico y tratamiento temprano dichas enfermedades y a su vez permite la optimización de la terapia farmacológica y/o la terapia génica a implementar. La formación de imágenes a nivel funcional y molecular ha tomado una nueva dirección desde la descripción del genoma humano. Nuevas investigaciones, incluyendo a nivel industrial, ha incrementado a nivel científico la demanda de este método. Se han estado generando programas para esto.
La formación de imágenes moleculares se diferencia de la formación de imágenes tradicional. En la formación de imágenes moleculares se usan biomarcadores que son usados para generar la imagen de objetivos particulares o trayectorias. En medicina un biomarcador es el término que se usa para referirse a una proteína de una cantidad mesurada en la sangre cuya concentración refleja la severidad o presencia de cierto estado de una enfermedad. Puede ser también introducido en un organismo para examinar la función de un órgano u otros aspectos relacionados con la salud, puede ser un isótopo radioactivo que permita localizar el problema a tratar. Los biomarcadores interactúan químicamente con su alrededor y conlleva a alterar la imagen a formar de acuerdo con los cambios moleculares que ocurren en el área de interés a analizar. Este proceso es muy diferente de métodos previos de formación de imágenes donde la formación de esta a nivel molecular difiere de las otras en calidad como densidad o contenido de agua. Esta habilidad para formar imágenes de cambios a nivel molecular genera una gran variedad de posibilidades a nivel médico como la ya mencionada detección temprana de enfermedades y para desarrollo farmacéutico.
Para alcanzar el éxito en la obtención de imágenes moleculares, las sondas deben de cumplir con ciertas características, como la de poseer alta afinidad y especificidad por su blanco molecular, y disponer de la capacidad de sobreponerse a barreras biológicas para alcanzarlo. A su vez, los sistemas de detección deben de ser lo suficientemente sensibles y rápidos para permitir la obtención de imágenes de una alta resolución.
Además, las imágenes moleculares permiten estudios cuantitativos impartiendo un mayor grado de objetividad en el estudio de estas áreas. Una tecnología emergente es MALDI-TOF que es la formación de imágenes a nivel molecular por medio de la Espectrometría de masas.
Diferentes áreas de investigación están siendo conducidas en el campo de la formación de imágenes moleculares. La mayoría de la investigación está centrada en detectar lo que es conocido como un estado de pre-enfermedad o estados moleculares que ocurren antes de que síntomas usuales de una enfermedad. Otro camino que se ha tomado es el de la formación de imágenes de la expresión de genes y el desarrollo de novedosos biomarcadores. Organizaciones como la Sociedad de Medicina Nuclear y el MICoE (Molecular Imaging Center of Excellence) han generado apoyo en el desarrollo de este campo. En Europa diferentes organizaciones también trabajan en este nuevo campo para generar profesionales.
Recientemente el término "imagen molecular" se ha aplicado a una gran variedad de técnicas de microscopia y nanoscopía entre las cuales están microscopia-TIRF (Total Internal Reflection Fluorescence), nanoscopía-STED (STimulated Emission Depletion) y Microscopia de Fuerza Atómica.
Modalidades de Formación de Imágenes[editar]
Existen diferentes modalidades que sirven para la formación de imágenes moleculares de una manera no invasiva.
Modalidades No Radiactivas[editar]
Son técnicas en las que no se utiliza material radiactivo para la formación de las imágenes moleculares. Dentro de estas, se encuentran las imágenes por resonancia magnética, las imágenes ópticas y las imágenes por ultrasonido.
Imagen por Resonancia Magnética[editar]
La imagen por resonancia magnética (MRI) se basa en los principios de la técnica espectroscópica de Resonancia Magnética Nuclear (RMN), sobre los procesos de absorción y emisión de energía dentro del rango de la radiofrecuencia en el espectro electromagnético.
Tiene la ventaja de permitir la obtención de una alta resolución espacial y es muy útil para imágenes morfológicas y funcionales. Pero la MRI también tiene desventajas, ya que los Agentes Convencionales de Contraste (ej: quelatos de galodinio) posee una sensibilidad de alrededor de 10-3 mol/L a 10-5 mol/L, la cual comparado con otros tipos de formación de imágenes, puede ser muy limitante. Existen mejoras para incrementar la sensibilidad de la MRI, incluyendo la hiperpolarización para incrementar la fuerza del Campo magnético, el "bombeo óptico" y la polarización dinámica nuclear. También existen unos esquemas de amplificación de señales basados en el intercambio químico que incrementan la sensibilidad.
En la actualidad se han desarrollado nuevos agentes de contraste[1] (ej: nanopartículas superparamagnéticas de óxido de hierro) para la obtención de imágenes por Resonancia Magnética. Estos tienen la ventaja de ser dirigidos gracias a la posibilidad de modificar la superficie de las nanopartículas, brindando un amplio repertorio de modificaciones posibles y usos. A su vez les confiere mayor especificidad y una sensibilidad en el orden nanomolar (10-9 mol/L). Entre esos, podemos nombrar a:
- CLIO (Cross-Linked Iron Oxide): se modifica la superficie de las nanopartículas de hierro, conjugándolas con gran variedad de ligandos (ej: anticuerpos, fluorocromos, etc). Presentan una vida media en sangre mayor respecto de otras sondas y mejoran significativamente la señal biológica.
- Nanoswitches: son nanopartículas de óxido de hierro magnéticas, que sufren ensamblaje y desensamblaje reversible en presencia de una enzima específica o compuesto químico, produciendo un cambio en la relajación magnética transversal. Se las utiliza para la obtención de imágenes de eventos dinámicos en diagnóstico in vitro (ej: detección de proteasas, oligonucleótidos, partículas virales, etc).
- Biosensores: son modificaciones de los nanoswitches, que permiten sensar concentraciones de ciertos analitos en solución (ej: glucosa o calcio) o actividades enzimáticas.
Imagen Óptica[editar]
Existe una gran variedad de formas de generar la imagen óptica. Estos métodos dependen de la Fluorescencia, la Bioluminiscencia, la Absorción o la Reflectividad como un recurso de contraste.[2]
La desventaja de las imágenes ópticas es la falta de profundidad de penetración, la cual refiere a la capacidad de una radiación electromagnética de atravesar un tejido determinado, desde su lugar de generación hasta el lugar de detección. Está relacionada con los fenómenos de absorción y la dispersión de la luz, siendo mayor cuanto menor sean estos últimos. Existen a su vez cromóforos que se encuentran dentro del organismo en tejidos (ej: hemoglobina, melanina y lípidos) que absorben la luz. En general, la absorción y la dispersión de la luz decrecen cuando aumenta la Longitud de onda. Por debajo de los 700 nm (longitudes de onda visibles), estos efectos de absorción y dispersión conllevan a una poca penetración de profundidad, de solamente unos milímetros. Por lo tanto solo en la región del espectro visible solo se pueden evaluar tejidos superficiales. Por encima de los 900 nm el agua interfiere en la proporción de la señal. Esto se debe a que el coeficiente de absorción del tejido es considerablemente menor cerca del Infrarrojo (IR). A estas longitudes de onda (700-900 nm) la luz puede penetrar a mayor profundidad.[3]
En la actualidad, la creciente disponibilidad de proteínas fluorescentes, tintes y diversas sondas fluorescentes han permitido la realización de estudios de expresión genética, función proteica, interacción proteína-proteína y de un gran número de procesos celulares.[4] Estas sondas con Fluorescencia permiten la realización de imágenes “in vivo”. Entre ellas, se encuentran los fluoróforos cercanos al infrarrojo, incluyendo tintes como el Kodak X-SIGHT, DyLight 750 y 800, entre otros. Los Puntos cuánticos son nanoestructuras semiconductoras que confinan el movimiento de los electrones. Estos tienen fotoestabilidad y pueden producir brillo. Son de gran interés debido a su eficiente ayuda para observar los sistemas circulatorio y renal, pero a largo plazo producen toxicidad.
Diferentes estudios han demostrado el uso de tintes infrarrojos:
- En comparación con la Gammagrafía y la formación de imágenes INR (Imágenes Químicas), un ciclopentapéptido etiquetado con 111-Indio y un Fluorocromo NIR es utilizado para la imagen de un xenograma de melanoma positivo.[5]
- Se usan RGD cercanos al infrarrojo que se usan para focalizar diferentes cánceres.[6]
- Un Fluoróforo IR han sido conjugados a Factores de crecimiento epidérmico para mostrar imágenes de tumores creciendo.[7]
- Los Fluoróforos IR comparados con otros tintes sugieren que longitudes de onda mayores producen una focalización de los agentes más rápido.[8]
- El Pamidronato ha sido marcado con fluoróforos IR y usado para generar imágenes de huesos para detectar la actividad de los Osteoblastos en un animal.[9]
- El fluoróforo IR marcado con GPI es un potente inhibidor del PSMA (Antígeno específico de la próstata).[10]
- El uso de albúmina marcado con un fluoróforo IR es un agente localizador para nodos linfáticos que intervienen en cánceres.[11]
Ultrasonido[editar]
El ultrasonido (US) es una técnica de imagen sencilla, no invasiva, que utiliza ondas de sonido de alta frecuencia (1-20MHz) para la adquisición de imágenes en el diagnóstico. Se basa en la emisión y recepción de ondas y su procesamiento para la obtención de imágenes, permite la evaluación de músculos y articulaciones. La velocidad de propagación de las ondas varía según las características del tejido (densidad y compresibilidad), provocando una reflexión diferencial o “eco” que llegará al transductor, y una atenuación.[12]
Para la obtención de imágenes moleculares, se utilizan diversos Agentes de Contraste de Ultrasonido (UCA), los cuales son típicamente microburbujas de perfluorocarbono o gas nitrógeno. Estos pueden modificarse mediante biotinilado, el cual permite su unión a un anticuerpo, brindando especificidad de unión a una estructura particular, mejorando la retrodispersión y permitiendo la obtención de imágenes moleculares de mejor calidad.
El Microultrasonido (micro-US) es una técnica específicamente desarrollada para investigación en animales pequeños por VisualSonics, la cual utiliza un rango de frecuencias entre 15-80 MHz. Permite delinear pequeñas estructuras con una buena resolución espacial y evaluar la expresión de diversos factores.[13] Su uso en la clínica se ve limitado, ya que la profundidad de penetración a altas frecuencias se ve drásticamente disminuida, debido a la gran atenuación por parte de los tejidos.
Modalidades Radiactivas[editar]
En modalidades PET y SPECT se utilizan sondas radiactivas, mientras que en TAC se utilizan radiaciones electromagnéticas producidas en un equipamiento diseñado a tal fin. En caso de las sondas radiactivas, estas pueden ser radionucleidos primarios o compuestos marcados, ya sea isotópica o no isotópicamente. En la marcación isotópica el radionucleido incorporado es un isótopo del elemento químico estable de la molécula original, mientras que en la no isotópica el radionucleido incorporado es un elemento ajeno a la estructura química de la molécula marcada.
Radiología Convencional (Rx)[editar]
En la radiología convencional se utiliza un tipo de radiación electromagnética altamente penetrante, denominada Rayos X (Rx), para la formación de imágenes anatómicas. Estos rayos poseen mayor energía que la luz visible y menor que los rayos gamma. La metodología se basa en la capacidad de los distintos tejidos de absorber dichos rayos, siendo aquellos con mayor densidad o compuestos por elementos de mayor peso atómico los que mayor absorción de la radiación presentan, como es el caso de los huesos. Los tejidos blandos, como es el caso de los órganos y vísceras presentan una menor absorción, ya que están compuestos por elementos de menor peso atómico. La imagen se obtiene sobre una placa radiográfica, producto de las diferencias en la atenuación que la radiación experimenta a través de los tejidos..
En esta modalidad se suelen utilizar sondas compartimentales, no específicas, denominadas "medios de contraste radiológico", que tienen la capacidad de absorber en mayor o menor grado que los tejidos blandos dichas radiaciones. Esos medios de contraste radiológicos permiten obtener una representación visual de estructuras, órganos y cavidades. El incremento de la densidad de contraste en los vasos sanguíneos depende exclusivamente de la concentración del medio de contraste en la sangre, del flujo sanguíneo regional, la perfusión vascular y la distribución del mismo.
Dichos medios de contraste deben de cumplir con ciertos requisitos:
- No deben de ser tóxicos.
- No deben de degradarse o metabolizarse en el organismo.
- En lo posible, deben de ser eliminados rápidamente del organismo.
- Deben de ser óptimamente tolerados.
- Los medios de contraste para las vías digestivas deben ser excretados en lo posible, sin absorción por la mucosa digestiva, o con una mínima absorción y que sean bien tolerados.
- Su empleo en el diagnóstico debe permitir una absorción óptima de los Rx y producir un buen contraste.
- Deben permanecer lo suficiente en el organismo investigado o en los sectores vasculares para permitir la exploración.
Tomografía Axial Computarizada (TAC)[editar]
El equipo de tomografía computarizado (CT) es un aparato que consta de 3 componentes principales: un tubo de rayos x, un sistema de detectores, y un sistema informático. La base física es similar al sistema de radiología convencional, con la diferencia que la placa radiográfica es remplazada por detectores. El tubo de rayos X emite un haz colimado que atraviesa al paciente, emergiendo un haz atenuado remanente que llega al detector, ubicado en posición opuesta, mientras ambos giran en torno al paciente. La computadora recopila y procesa la información recogida y reconstruye la imagen digital para mostrarla en un monitor.[14]
Tomografía Computarizada por Emisión de Fotones Individuales (SPECT)[editar]
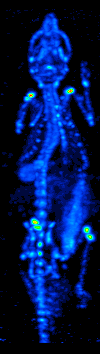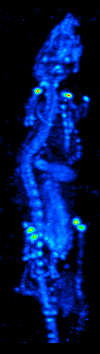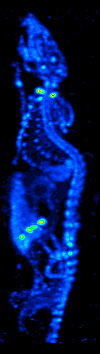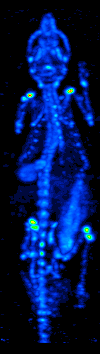
El desarrollo de la tomografía computarizada en los 70s permitió generar el mapa de distribución de los radioisótopos en el cerebro y conllevó a la técnica ahora llamada SPECT. Esta modalidad permite la generación de imágenes funcionales, mediante la utilización de radionucleidos que emite rayos gamma. Existen diferentes tipos de sondas radioisotópicas que pueden ser usadas dependiendo de la aplicación. El Xenón 133, por ejemplo, es un gas que sirve como un agente marcador de gran utilidad para el diagnóstico de la evaluación de funciones pulmonares y en la generación de imágenes cerebrales para evaluar el flujo sanguíneo de una región del cerebro.
El equipo de detección es conocido como Cámara Gamma y permite la obtención de imágenes bidimensionales. Mediante la adquisición y procesamiento de una serie de imágenes 2D en varios ángulos diferentes se puede generar imágenes funcionales tridimensionales. Existen diversos modelos de cámaras gamma, dirigidos para el uso exclusivo de animales de laboratorio o para su uso en humanos. El equipo consta de 4 componentes principales:
- Colimador: consiste en un teselado formado por tubos hexagonales de plomo, que cumple la función de filtro, evitando que llegue al material centellador toda aquella radiación que no incida de forma paralela a los orificios que posee (ya sea que provenga del medio o de la misma fuente radiactiva dentro del paciente). Estas radiaciones serán las que alcancen el material centellador, mientras que aquellos que inciden con otro ángulo son absorbidos por las paredes de plomo de los tubos, evitando que lleguen al centellador.
- Material centellador: es un material (ej: ioduro de sodio) que emite fotones visibles cuando los rayos gamma interactúan con él.
- Tubos fotomultiplicadores: permiten convertir la señal de luz producida por el material centellador a una señal eléctrica. Por otro lado, se asocian a un circuito de posicionamiento, que permite luego la formación de la imagen.
- Computadora: procesa la información, reconstruyendo una imagen en la pantalla.
Tomografía por Emisión de Positrones (PET)[editar]
La Tomografía por emisión de positrones (PET) es una técnica de medicina nuclear que permite la generación de imágenes funcionales. Los radionucleidos que forman parte de las sondas utilizadas suelen tener un tiempo de vida media relativamente corto (2-110 minutos aproximadamente), tales como 13N, 15O, 18F, y presentan un decaimiento radiactivo de tipo beta positivo, produciendo un positrón. Cuando dicho positrón se aniquila con un electrón del medio, se emiten dos fotones de 511 keV cada uno en direcciones opuestas, formando un ángulo de 180°. Los fotones de aniquilación se detectan en coincidencia en el circuito detector del PET por lo cual no se recurre a la colimación absortiva para la formación de la imagen sino a la línea de respuesta que se establece entre ambos fotones.
Es de gran utilidad en el área de investigación pre-clínica en animales, así como en la clínica, para el diagnóstico en pacientes oncológicos mediante el uso de 18F-FDG. Otras áreas dentro de la medicina utilizan esta metodología, como es el caso de la neurología, cardiología, tanto en el diagnóstico como para evaluar la farmacocinética.
Ver[editar]
EMMI European Master in Molecular Imaging
Referencias[editar]
- ↑ Sosnovik, David E, Emerging concepts in molecular MRI, Current Opinion in Biotechnology 2007, 18:4–10
- ↑ Weissleder, R., Mahmood, U., Molecular Imaging, Radiology 2001; 219:316-333. Download PDF
- ↑ Olive D.M., Kovar, J.L., Simpson, M.A., Schutz-Geschwender, A., A systematic approach to the development of fluorescent contrast agents for optical imaging of mouse cancer models, Analytical Biochemistry 2007;(367), #1, 1-12. Download PDF
- ↑ Ntziachristos, Vasilis (1 de enero de 2006). «Fluorescence Molecular Imaging». Annual Review of Biomedical Engineering 8 (1): 1-33. PMID 16834550. doi:10.1146/annurev.bioeng.8.061505.095831. Consultado el 23 de junio de 2016.
- ↑ Houston, J.P., Ke, S. Wang, W., Li, C., and Sevick-Muraca, E.M., J. Biomed. Optics 10, 054010 (2005)
- ↑ Chen, K, Xie, J., Chen, X., Molecular Imaging, Vol 8, No 2 (March-April, 2009): pp 65-73. [1] | Download PDF]
- ↑ Kovar, J.L., Johnson, M.A., Volcheck, W.M., Chen, J., and Simpson, M.A., Am. J. Pathol. 169, 1415 (2006). «Copia archivada». Archivado desde el original el 22 de febrero de 2007. Consultado el 30 de marzo de 2010. | Download PDF]
- ↑ Adams, K.E., Ke, S., Kwan, S., Liang, F., Fan, Z., Lu, Y., Barry, M.A., Mawad, M.E., and Sevick-Muraca, E.M., Journal of Biomedical Optics 12, 024017 (2007).
- ↑ Zaheer, A., Lenkinski, R.E., Mahmood, A., Jones, A.G., Cantley, L.C., Frangioni, J.V., Nat. Biotechnol. 19, 1148 (2001).
- ↑ Humblet, V., Lapidus, R., Williams, L.R., Tsukamoto, T., Rojas, C., Majer, P., Hin, B., Ohnishi, S., De Grand, A.M., Zaheer, A., Renze, J.T., Nakayama, A., Slusher, B.S., and Frangioni, J.V.. Molecular Imaging 4, 448 (2005).
- ↑ Ohnishi, S., Lomnes, S.J., Laurence, R.G., Gogbashian, A., Mariani, G., and Frangioni, J.V., Molecular Imaging 4, 172 (2005).
- ↑ Carlos Pineda V., Principios Físicos Básicos del Ultrasonido, Rev. chil. reumatol. 2009; 25(2):60-66
- ↑ Liu H, Chen Y, Yan F, Han X, Wu J, Liu X, Zheng H. Ultrasound Molecular Imaging of Vascular Endothelial Growth Factor Receptor 2 Expression for Endometrial Receptivity Evaluation. Theranostics 2015; 5(2):206-217. doi:10.7150/thno.9847. Available from http://www.thno.org/v05p0206.htm
- ↑ S. Hernández Muñiz, Introducción a la tomografía computarizada, Rev Esp Med Nucl. 2006;25(3):206-16
Otras Lecturas[editar]
- Fuchs V.R., Sox H.C. Jr., Health Affairs 2001: 20(5), 30–42
- Weissleder R, Mahmood U. Molecular imaging, Radiology 2001: 219:316-333
- Piwnica-worms D, Luker KE. Imaging Protein-protein interactions in whole cells and living animals. Ernst Schering Res Found Workshop. 2005;(49):35-41.
- Massoud TF, Gambhir SS. Molecular imaging in living subjects: seeing fundamental biological processes in a new light, Genes & Development 2003: 545-580
Links[editar]
- European Master in Molecular Imaging Archivado el 29 de enero de 2010 en Wayback Machine.
- Society for Molecular Imaging
- Understanding Molecular Imaging and biomarker usage
- Annual Imaging Meeting
- Molecular Imaging Research update Archivado el 11 de agosto de 2020 en Wayback Machine.
- Molecular Imaging Center
- Understanding Near-Infrared Imaging - Recurso para entender mejor el funcionamiento del "Near-Infrared Imaging”
- Society for Neuroscience
- European Society for Molecular Imaging
- European Institute for Biomedical Imaging Research
