Efecto trans
En química inorgánica, el efecto trans es la labilidad (hacer más reactivo) de ligandos que son trans a ciertos otros ligandos, que por lo tanto pueden considerarse como ligandos transdireccionadores. Se atribuye a los efectos electrónicos y es más notable en los complejos plano-cuadrados, aunque también se puede observar en los complejos octaédricos.[1] El efecto cis se observa con mayor frecuencia en complejos de metales de transición octaédricos.
Además de este efecto trans cinético, los ligandos trans también influyen en el estado fundamental de la molécula, los más notables son las longitudes de enlace y la estabilidad. Algunos autores prefieren el término influencia trans para distinguirlo del efecto cinético,[2] mientras que otros usan términos más específicos como efecto trans estructural o efecto trans termodinámico.[1]
Efecto trans cinético[editar]
La intensidad del efecto trans (medida por el aumento en la tasa de sustitución del ligando trans) sigue esta secuencia:
- F−, H2O, OH− < NH3 < py < Cl− < Br− < I−, SCN−, NO2−, SC(NH2)2, Ph− < SO32− < PR3, AsR3, SR2, CH3− < H−, NO, CO, CN−, C2H4
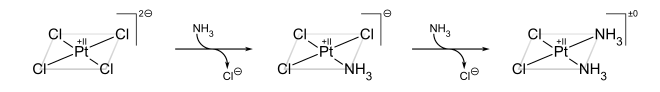
El ejemplo clásico del efecto trans es la síntesis de cisplatino y su isómero trans.[3] A partir del PtCl42−, el primer ligando NH3 se agrega a cualquiera de las cuatro posiciones equivalentes al azar. Sin embargo, dado que el Cl− tiene un mayor efecto trans que el NH3, el segundo NH3 se adiciona trans al Cl− y, por lo tanto, cis al primer NH3:
Si, por otro lado, uno comienza con Pt(NH3)42+, el producto trans se obtiene en su lugar:
Efecto trans termodinámico[editar]
En química de coordinación, se denomina efecto trans termodinámico o estructural o influencia trans, al efecto de un ligando sobre las propiedades del estado fundamental (longitud de enlace, espectro IR...) sobre un ligando que está en posición trans con respecto a él. "La influencia trans se define como la medida en que un ligando debilita un enlace trans en el estado de equilibrio".
El efecto estructural trans puede cuantificarse experimentalmente mediante cristalografía de rayos X, y se observa en forma de alargamiento del enlace entre el metal y el ligando ubicado en la posición trans de un ligando que induce un efecto trans. Se observa un alargamiento de hasta 20 μm con los ligandos que inducen el efecto trans más fuerte, como el ion hidruro. También se puede observar una influencia cis, pero es menos sensible que la influencia trans. La importancia relativa de las influencias cis y trans depende de la configuración electrónica de metal. Se han propuesto modelos a partir de sus orbitales atómicos.[4]

Referencias[editar]
- ↑ a b Coe, B. J.; Glenwright, S. J. Trans-effects in octahedral transition metal complexes. Coordination Chemistry Reviews 2000, 203, 5-80.
- ↑ Robert H. Crabtree (2005). The Organometallic Chemistry of the Transition Metals (4th edición). New Jersey: Wiley-Interscience. ISBN 0-471-66256-9.
- ↑ George B. Kauffman, Dwaine O. Cowan (1963). «cis- and trans-Dichlorodiammineplatinum(II)». Inorg. Synth. 7: 239-245. doi:10.1002/9780470132388.ch63.
- ↑ Kirsty M. Anderson et A. Guy Orpen (2001). «On the relative magnitudes of cis and trans influences in metal complexes» (en inglés) (24). Chemical Communications. pp. 2682-2683. doi:10.1039/B108517B.
- ↑ A. Pidcock, R. E. Richards et L. M. Venanzi (1966). «195Pt–31P nuclear spin coupling constants and the nature of the trans-effect in platinum complexes» (en inglés). Journal of the Chemical Society A: Inorganic, Physical, Theoretical. pp. 1707-1710. doi:10.1039/J19660001707.