Damnacantal
| Damnacantal | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
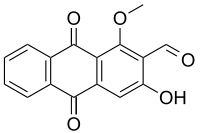
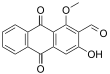
| 3-Hidroxi-1-metoxi-9,10-dioxoantraceno-2-carbaldehído | ||
| General | ||
| Otros nombres | 2-Formil-3-hidroxi-1-metoxiantraquinona | |
| Fórmula estructural |
 | |
| Fórmula molecular | C10H16O5 | |
| Identificadores | ||
| Número CAS | 477-84-9[1] | |
| ChEBI | 93633 | |
| ChEMBL | CHEMBL212948 | |
| ChemSpider | 2843 | |
| PubChem | 2948 | |
| Propiedades físicas | ||
| Apariencia | cristales amarillo pálido | |
| Densidad | 1461 kg/m³; 1,461 g/cm³ | |
| Masa molar | 282,0528 g/mol | |
| Punto de fusión | 484 K (211 °C) | |
| Punto de ebullición | 805 K (532 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El Damnacantal es un compuesto orgánico natural que se ha aislado, estudiado y sintetizado por sus propiedades fitoquímicas y anticancerígenas.
Historia[editar]
Fue aislado y caracterizado por primera vez por S. Nonomura en 1955 de las raíces de las plantas de la Familia Rubiaceae: Damnacanthus major y Damnacanthus indicus,[2] de ahí su nombre.
Sin embargo, Nonomura reportó una similitud cercana entre el damnacantal y otra antraquinona aislada antes, en el año 1894 por Perkin y Hummel la cual presentó propiedades físicas similares: punto de fusión 208 °C y fórmula molecular C
16H
10O
5 de la planta Morinda umbellata L.[3]
Características[editar]
El damnacantal es una antraquinona, con fórmula química C
16H
10O
5, ha sido obtenido por extracción de raíces de plantas del género Morinda y Damnacanthus junto con otras antraquinonas empleando solventes como etanol, metanol, etil acetato y cloroformo. Puede extraerse del Noni (Morinda citrifolia), encontrándose principalmente en la raíz de esta planta.[4]
Es un sólido que se presenta en forma de cristales aciculares de color amarillo pálido. Su punto de fusión es 211 °C. Al igual que otras antraquinonas con estructura similar como la alizarina, posee propiedades como pigmento natural.
Síntesis[editar]
Ha sido aislado y sintetizado en diversos trabajos y su estructura química ha sido caracterizada por 1H NMR, 13C NMR, espectroscopía Infrarroja y Difracción de Rayos X.
Propiedades[editar]
Se ha comprobado que es el inhibidor más potente de la p56lck tirosina quinasa.[5] Un estudio publicado en la revista Scientific Reports en enero de 2015 reveló que el damnacantal tiene un efecto directo in vitro e in vivo sobre una proteína específica, c-Met, también conocida como MET o receptor del factor de crecimiento de hepatocitos, la cual ha sido identificada como un nuevo blanco potencial para el tratamiento terapéutico del carcinoma hepatocelular. Además de tener un efecto sobre c-Met, se identificó en dicho estudio que el damnacantal inhibe el crecimiento y el potencial clonogénico de las células de carcinoma hepatocelular Hep G2, al igual que induce la apoptosis de Hep G2.[6]
Referencias[editar]
- ↑ Número CAS
- ↑ Nonomura S. (1955). «Chemistry of Damnacanthus genus. I. The anthraquinone coloring matter from Damnacanthus major, D. major var. parvifolius, and D. indicus var. microphyllus». Yakugaku Zasshi 75: 219-227.
- ↑ Ayyangar N. R., Joshi B. S., Venkataraman K. (1959). «Anthraquinone and Anthrone Series-XXIII* The non-identity of 1:3:8 Trihydroxy-2-hidroxymethyl-anthraquinone with Versicolorin and a synthesis of Damnacanthol and Damnacanthal». Tetrahedron 6 (4): 331-337. doi:10.1016/0040-4020(59)80013-2.
- ↑ Anekpankul T, Goto M, Sasaki M, et al. (julio de 2007). «Extraction of anti-cancer damnacanthal from roots of Morinda citrifolia by subcritical water». Separation and Purification Technology 55 (3): 343-349. doi:10.1016/j.seppur.2007.01.004.
- ↑ Faltynek CR, Schroeder J, Mauvais P, et al. (septiembre de 1995). «Damnacanthal is a highly potent, selective inhibitor of p56lck tyrosine kinase activity». Biochemistry 34 (38): 12404-10. PMID 7547985. doi:10.1021/bi00038a038.
- ↑ Garcia-Vilas, J. A., Quesada A. R., Medina, M. A. (27 de enero de 2015). «Damnacanthal, a noni anthraquinone, inhibits c-Met and is a potent antitumor compound against Hep G2 human hepatocellular carcinoma cells». Scientific Reports 5 (8021). ISSN 2045-2322. doi:10.1038/srep08021.
