Cilio

Los cilios o cilias[1] (Et: del latín cilĭum, ceja, o tal vez del legítimo griego κυλίς, kilis, párpado o pestaña)[2] son unos orgánulos celulares envueltos por el citosol y la membrana plasmática, que se presentan como apéndices cortos con aspecto de pestaña. Contienen una estructura central altamente ordenada constituida por más de 250 proteínas diferentes.[3]
Las proteínas relacionadas con la función ciliar son llamadas por algunos con el término cilioma y ha sido calculado en ~680 proteínas.[4] Principalmente se trata de microtúbulos con sus proteínas asociadas, que forman la estructura central llamada el axonema de la cilia.[5][6]
Los cilios móviles son numerosos en ciertos tipos de células, forman parte de los epitelios como en el aparato respiratorio.
Los cilios primarios son inmóviles, son únicos en la célula y se encuentran en la gran mayoría de los tipos celulares, como mecanosensores o quimiosensores. En los vertebrados, prácticamente todos los tipos celulares tienen cilios primarios como los osteocitos, las células beta, las células del túbulo renal, los fibroblastos y las neuronas, o proceden de células que los tuvieron durante su desarrollo embrionario.
Las mutaciones en genes de proteínas ciliares o proteínas presentes en la base del cilio o cerca de ella conducen a trastornos (patologías) denominadas "ciliopatías", como la enfermedad poliquística renal, y también a algunos procesos de carcinogénesis.
Historia[editar]

- Las primeras observaciones de cilios bien podrían atribuirse a Anton van Leeuwenhoek, quien en su Continuatio arcanorum Naturae, publicado en 1697, describe en muchos lugares estas diminutas estructuras.
- En 1786 Otto Müller emplea por primera vez el nombre de cilio para referirse a "los pies increíblemente finos" que Leeuwenhoek describió en los animálculos.
- En 1835 Oken y William Sharpey, amigo de Charles Darwin observan por primera vez los cilios en la superficie de un animal pluricelular, en concreto una almeja. Cinco años más tarde publicará una revisión exhaustiva de todo lo que se sabía en la época de los cilios en todos los animales, incluidos los vertebrados.[7] También en 1835, Jan Purkinje y Gustav Valentin publican el primer tratado en el que se estudian los cilios de las vías respiratorias y otros órganos huecos de diversos reptiles, aves y mamíferos, si bien opinan que tales apéndices debían ser movidos por fibras musculares microscópicas.[8] C. G. Ehrenberg apoya en 1838 este modelo, añadiendo que los cilios son varillas rígidas. Sin embargo, Sharpey opina que los cilios no son rígidos y poseen un movimiento más bien "de abanico".[7]
- En 1898 Henneguy y Lenhossék observaron independientemente que los centriolos del centrosoma y los cuerpos basales de los cilios son estructuras idénticas.[9]
- En 1900 el término «undulipodio» fue propuesto en la literatura científica rusa para referirse conjuntamente a las estructuras celulares cilios y flagelos.
- En 1954 Fawcet y Porter caracterizan el patrón 9+2 del axonema, y demuestran que es una extensión del cuerpo basal y que está relacionado con el patrón de construcción del centriolo.[10]
- En 1956 De Robertis y en 1957 Porter advierten que los cilios que se encuentran en estructuras sensoriales poseen una configuración de microtúbulos 9+0.
- Diversos trabajos en los años 1960 (Barnes, 1961; Sorokin, 1962; Grillo y Palay, 1963) denominan a estas estructuras "cilios primarios" y los encuentran en los más diversos tejidos de vertebrados.[10]
- En 1965 Gibbons y Rowe identifican y dan nombre a una de las proteínas del axonema, la dineína. Tres años después, Mohri hace lo mismo con la tubulina.[11] La identificación de la kinesina tuvo que esperar hasta 1985, y fue efectuada por Ron Vale y colaboradores en estudios sobre el axón gigante del calamar.[12]
- En 1971 Summers y Gibbons establecen el modelo de deslizamiento de los microtúbulos del axonema a partir del axonema del erizo de mar.[11]
- En 1985 la investigadora Lynn Margulis propuso el nombre «undulipodio» para referirse conjuntamente a las estructuras celulares que poseen estas características, los cilios y flagelos.[13] La distinción entre estos últimos se basa principalmente en su tamaño (unos 12-14 μm), número por célula (suelen ser muchos, con excepción de los cilios primarios y nodales,[14] mientras que los flagelos uno o dos) y en su caso, por el patrón de movimiento (los cilios baten como un remo, son inmóviles o crean un vórtice, mientras que los flagelos no ondulan).
- En 1995 Wheatley, en contra de la corriente general que consideraba a los cilios primarios como vestigiales, les atribuye un papel en la función renal como "sensor de flujo" y sugiere que podría explicar diversas patologías de no funcionar correctamente.[10]
Características[editar]
Casi todos los eucariotas poseen cilias. Son estructuras móviles que sobresalen de la superficie celular.[15]
Los eucariotas que tienen pared celular, carecen habitualmente de cilias, es especialmente cierto para los hongos y rodofíceas.[16] En plantas existen las notables excepciones de algunos espermatozoides, como los de Ginkgo biloba o Cycas revoluta y los de criptógamas.[17] Los organismos aciliados tampoco poseen centriolos, por lo que algunos científicos creen que la función específica de estos es la formación de cilios o flagelos.[18] Significativamente, estos organismos tampoco poseen las tubulinas "especiales" (δ, ε, ζ y η) que permiten organizar el centriolo.[19]
En vertebrados, prácticamente todos los tipos celulares tienen cilios primarios o proceden de células que los tuvieron durante su desarrollo embrionario.[20]
Los cilios móviles son numerosos en ciertos tipos de célula, forman parte de los epitelios del aparato respiratorio, del epéndimo o del aparato reproductor,[21] mientras que los cilios primarios son inmóviles, son únicos en la célula y se encuentran en la gran mayoría de los tipos celulares, como las células beta del páncreas, los osteocitos, las células del túbulo renal, los fibroblastos y las neuronas.[10]
Microaquitectura[editar]
Con el microscopio óptico las cilias se ven como «pelitos cortos» o con aspecto de «cepillo» que se extienden más allá de la membrana celular. Sus dimensiones son de ~2-10 micrómetros de longitud y ≈0,25 micrómetros de diámetro.[15]
Ultraestructura[editar]
Con el microscopio electrónico se pudo aclarar la estructura fina de la cilia.
Estudiando su axonema las cilias se pueden dividir en cuatro grupos: móviles con configuración axonémica 9+2, móviles 9+0 (cilios nodales), cilios sensoriales 9+2 (cilios vestibulares y algunos nodales) y cilios sensoriales 9+0 (cilias primarias).[15] De las cilias primarias (9+0) se pueden derivar muchos cilios modificados en estructuras especializadas, como las de los órganos fotorreceptores o los sensilia de insectos.[22][10] Son posibles otras configuraciones de microtúbulos, como 9+1, 9+3 y 9+4 en células embrionarias.[23]
Dada su ubicuidad, los cilios están implicados en las funciones más diversas. Los cilios móviles intervienen a la propulsión de organismos unicelulares, la limpieza de las vías respiratorias y el desplazamiento de los gametos, pero también contribuyen a regular el balance hídrico en los órganos excretores, la circulación de fluidos en la cavidad celómica, el sistema nervioso, el filtrado de partículas en las branquias. Los cilios sensoriales contribuyen al reconocimiento de individuos compatibles en el apareamiento de protistas, reconocimiento y anclaje al hospedador en los protistas parásitos,
geotaxia en los moluscos, mecanorrecepción en artrópodos, y en la quimiorrecepción en los vertebrados.[24]
Métodos de estudio[editar]

A nivel macroscópico, existen pruebas diagnósticas que permiten verificar la función ciliar con fines clínicos. Uno de los métodos más baratos y que cuenta con una aceptable fiabilidad es el test de la sacarina, que permite determinar el tiempo de transporte mucociliar nasal (TTMCN).[25]
- Entre los organismos modelo que se han empleado en el estudio de diversos aspectos de la estructura y la función de los cilios, debido a las ventajas que ofrecen, cabe destacar los protozoos Chlamydomonas y Paramecium, el nemátodo Caenorhabditis elegans, embriones de erizo de mar o distintos tejidos de mamífero, como las células epiteliales de vías aéreas, células tubulares renales o células embrionarias nodales.[26]
- Se han desarrollado numerosas técnicas de cultivo celular de tejidos de mamífero con cilios móviles, para fines clínicos e investigación. En el cultivo de epitelio ciliado de vías respiratorias se emplean métodos monocapa, monocapa secuencial, con interfaz aire-líquido y tridimensionales. Estos cultivos requieren el uso de técnicas en cámaras bifásicas, un sustrato de gel de colágeno con la suficiente profundidad, control del nivel de calcio y la vitamina A, factores de crecimiento como el factor de crecimiento epidérmico, insulina, y hormonas esteroideas para la diferenciación de las células mucosas, y la adición de antibióticos.[27][28][29][30]
El microscopio óptico se ha utilizado durante más de tres siglos para el estudio de los cilios. Las tinciones habituales en las técnicas histológicas pueden revelarlos. Sin embargo, cuando se trata de estudiar el movimiento de estos orgánulos, es necesario utilizar microscopios que permitan la observación de células vivas.
- Dependiendo del organismo o del tipo celular a observar, se puede emplear un microscopio de campo oscuro, de contraste de fases o de interferencia diferencial de contraste (DIC), siendo este último el más empleado. Adicionalmente, y dada la elevada frecuencia de batido (en ocasiones hasta 100 Hz) se precisa de métodos de videograbación de alta velocidad y resolución, y software de análisis de imagen, movimiento o flujo.[24][31][32]

La inmunofluorescencia se emplea especialmente en la inmunolocalización de algún componente concreto del cilio, o bien para trazar el transporte intraflagelar. En muchos casos es importante inmovilizar las células para posteriores manipulaciones. Esto se puede efectuar confinándolas entre dos vidrios con una separación estrecha, procurando no distorsionar las estructuras celulares.
- Se emplean algunos pasos especiales, como la adición de un tampón químico especial para estabilizar microtúbulos (MTSB), o la elección cuidadosa de un detergente permeabilizador para evitar que se extraigan los componentes desados. Son habituales el MTSB-tritón y el Nonidet. En ocasiones es recomendable la fijación con metanol en frío, ya que fija y permeabiliza la muestra simultáneamente. Los tampones de lavado tras la fijación son un paso crítico. Por ejemplo, Chlamydomonas funciona mejor con Hepes (pH=6,8) mientras que los cultivos de vertebrados dan mejores resultados con Pipes (pH=7,2).
- La elección del anticuerpo primario depende de lo que se desee observar. Para fines generales se puede usar anticuerpos monoclonales contra alfa-tubulina acetilada de conejo, mientras que en el caso del estudio del transporte intraflagelar puede servir anti-IFT27. Es necesario considerar si el anticuerpo va a inactivar el blanco elegido. Se pueden utilizar anticuerpos marcados con oro en experimentos de inmunolocalización por microscopía electrónica, procurando que el tamaño de los anticuerpos sea el menor posible.[33][34]
- Se emplean algunos pasos especiales, como la adición de un tampón químico especial para estabilizar microtúbulos (MTSB), o la elección cuidadosa de un detergente permeabilizador para evitar que se extraigan los componentes desados. Son habituales el MTSB-tritón y el Nonidet. En ocasiones es recomendable la fijación con metanol en frío, ya que fija y permeabiliza la muestra simultáneamente. Los tampones de lavado tras la fijación son un paso crítico. Por ejemplo, Chlamydomonas funciona mejor con Hepes (pH=6,8) mientras que los cultivos de vertebrados dan mejores resultados con Pipes (pH=7,2).
Los primeros estudios con microscopía electrónica lograron determinar las características ultraestructurales del axonema y otros elementos de la estructura ciliar. Una nueva técnica, la tomografía crioelectrónica, en la que las muestras son vitrificadas a temperaturas muy bajas (algunos microscopios son enfriados con helio líquido) y posteriormente fotografiadas desde todos los ángulos, reconstruyéndose posteriormente una imagen tridimensional de la estructura con una resolución que alcanza los 2 nm. Una ventaja adicional de esta técnica debido a la rápida congelación, es que permite detener la célula o los complejos proteicos en un estado particular.[35]
Algunos elementos celulares, como los estereocilios pueden confundirse con los cilios al microscopio óptico, pero en realidad están estructuralmente relacionados con las microvellosidades.[36]
Estructura[editar]
Las cilias son orgánulos cortos que están rodeados por membrana plasmática en su porción extracelular. Por su morfología extracelular parecen como salidas desde la membrana plasmática en forma de dedo de guante, cortos y con un contenido que se continua dentro del citoplasma. Muestran una forma cilíndrica, de diámetro uniforme en toda su longitud, con una terminación libre redondeada, semiesférica.
Estos orgánulos están dotados de un armazón compleja, basada en microtúbulos y que es denominada axonema. El axonema se origina en la base del cilio y por debajo de la membrana plasmática, en una estructura compleja denominada cuerpo basal.[37][38][39]
La estructura el cilio consta de cuatro compartimentos principales: el cuerpo basal, la zona de transición, el axonema y la membrana ciliar.
Membrana ciliar[editar]
Ultraestructura[editar]
La membrana del cilio se continúa a través de la zona apical de la membrana plasmática. Se forma por fusión de vesículas alrededor del centriolo o de compartimentos especializados, y consta de una serie de dominios que se distinguen entre sí por su composición de proteínas y probablemente también de lípidos, adaptada esta última en cada caso al medio donde se desenvuelven. Algunos estudios indican que al menos, en algunos casos, la fluidez de la membrana puede responder a señales como el ATP extracelular.[40] Las proteínas de transmembrana cuentan con glicocálix. Se sabe que las lectinas ciliotóxicas PA-IL y PA- IIL de Pseudomonas aeruginosa se unen a él en el epitelio ciliado de las vías aéreas humanas, probablemente en residuos de D-galactosa y L-Fucosa, provocando la inmovilización de los cilios.[41] Se puede distinguir los siguientes dominios de membrana:
Dominio periciliar[editar]
En el que en cilios primarios se puede localizar la proteína galectina-3. Es especialmente importante en las células fotorreceptoras, que como se dijo anteriormente son cilios especializados. En este caso encontramos la proteína responsable de síndrome de Usher, que está implicada en el transporte molecular, y al menos en anfibios se ha demostrado que participa en el transporte de vesículas.[42] En esta región se observa a veces una depresión de la membrana plasmática llamada "caveola".[43]

Base de la membrana ciliar[editar]
Mediante el uso del colorante laurdan se ha puesto en evidencia que posee una bicapa lipídica altamente condensada y ordenada, con un contenido en colesterol libre y abundancia de balsas lipídicas característica.[44]
En muchas especies y tipos celulares, y especialmente en los cilios de vías aéreas y oviducto se encuentra asociada una estructura especializada, el "collar ciliar", un complejo membrana-citoesqueleto en forma de collar de perlas en espiral, situado donde los microtúbulos y el cuerpo basal hacen contacto con la membrana plasmática y descubierto en 1972 mediante técnicas de criofractura. Está formado por varias "vueltas", en número dependiente de la especie y tipo celular, de partículas de intramembrana con extensiones espinosas que las conectan con cada doblete del cuerpo basal debajo de la zona de transición con el axonema. Se le atribuye la función de anclar el cuerpo basal a la membrana plasmática, pero además, en proximidad con esta zona especializada se han encontrado proteínas de transporte, lo que sugiere que se trata de un lugar en el que se ensamblan las cargas dirigidas hacia el axonema y el resto de la membrana ciliar. También se piensa que junto con la zona densa lipídica constituye una barrera que impide la difusión de las proteínas del resto de la célula a la membrana y al citoplasma ciliar por lo que en ocasiones se le ha denominado "complejo de poro ciliar", en alusión al poro nuclear, con el que guarda además relación filogenética.[19] Aunque la naturaleza de las proteínas que la forman aún no se ha caracterizado, se ha visto que están implicadas en el transporte de calcio.[43] Una proteína característica de este domino, presente en varios tipos ciliares, es el regulador de la GTPasa de la retinitis pigmentosa (RPGR). La importancia estructural del collar se manifiesta por el hecho de que queda desestructurado en infecciones por Bordatella pertussis y Micoplasma. También porque el punto de ruptura en la deciliación por Ca2+ sucede justo por encima de él, persistiendo tras la eliminación del cilio.[5]
Membrana del tallo ciliar[editar]
Aunque se extiende y es continua con la membrana plasmática, existen notables diferencias en la composición, en especial, de proteínas. Además de las discutidas en este apartado, también se encuentran algunas correspondientes al sistema de transporte intraflagelar.
En los organismos unicelulares, debido a su contacto directo con el medio externo, los cilios son un punto esencial en la transducción de señales que controlan muchos aspectos de la célula, como las circunstancias ambientales idóneas o el crecimiento si existe aporte de alimento. También entraría en este apartado los receptores necesarios para garantizar la singamia en la reproducción sexual. Todo ello permitiría dirigir el impulso de los cilios a las condiciones más favorables.[45][46] A ello contribuyen cuatro tipos de proteínas:
- Receptores de nucleótidos cíclicos y ciclasas.
- Canales de calcio.
- Receptores implicados en el control del crecimiento celular.
- En el ejemplo de Chlamydomonas, además de las mencionadas anteriormente, existen cuatro proteínas que contienen un dominio PAS (de PYP-like sensor domain, dominio sensor semejante a PYP), implicado en la recepción de diversos estímulos ambientales, como el estado red-ox, el nivel de oxígeno, la luz o sustancias de pequeño tamaño molecular.
En Metazoos se presume la persistencia evolutiva de estas cuatro categorías de proteína de membrana, en especial la función sensorial, incluso en cilios móviles. Algunos ejemplos:
- En los cilios de vías aéreas, a pesar de que se precisa un control preciso de la frecuencia de batido, sólo se ha encontrado una proteína semejante a las adenilil ciclasas en los cilios olfatorios y los cilios móviles epiteliales cercanos a los primeros.
- En cuanto a los canales, el de la proteína de transmembrana reguladora de la conductancia de la fibrosis quísitica (CFTR) se encuentra en la zona apical de los cilios móviles de vías aéreas, mientras que en los inmóviles puede localizarse en toda la membrana. El ambiente químico puede ser percibido por proteínas como las policistinas (PKD's) y fibrocistinas.
- En el infundíbulo del oviducto, el epitelio ciliado muestra angiopoioetinas de los tipos tie-1 y tie-2, junto con el complejo de policistinas 1 y 2 y el canal de iones TRPV4. En conjunto, estas proteínas pueden contribuir a diversas funciones del transporte de gametos, como su reconocimiento e impulsión.
- En el control del crecimiento celular y el desarrollo encontramos el receptor de la somatostatina (SSTR3), el receptor del factor de crecimiento derivado de las plaquetas (PDGFRα) y todos los implicados en las vías de señalización hedgehog y Wnt que discutiremos en los cilios implicados en el desarrollo y la determinación del patrón corporal.[47][5]
Especializaciones apicales[editar]
En muchos cilios se observa que se pierde la estructura del axonema típico y sólo continúan hasta el ápice del cilio los túbulos A del doblete, así como los dobletes centrales. En esta zona de la membrana que se adelgaza, se ha observado una proteína, llamada "sentan" palabra que procede del japonés: punta (尖端 sentan?), que en ratón tiene una masa molecular de 16,4 KiloDaltons (KDa) específica de células epiteliales ciliadas. Se observa que anclan los singletes de microtúbulos de la porción apical a la membrana, que dada la abundancia de esta proteína, distingue un dominio que en ocasiones se ha denominado "dominio sentan".[48]
También en muchas ocasiones puede observarse en la parte más alta del cilio un número variable (3-7) de púas. Se trata de proteínas con glicocálix, que forman la llamada "corona ciliar", de unos 31 nanómetros (nm) y que presenta una estructura periódica a microscopía electrónica de transmisión. Cuando se disuelve mediante detergentes la membrana ciliar, persiste la estructura, por lo que es evidente que está anclada al axonema. Algunas funciones que se le suponen son el ensamblaje de microtúbulos, movimiento ciliar y transporte mucociliar.[49]
Formación de la membrana[editar]
En Trypanosoma se ha comprobado que la extensión de la membrana flagelar no depende del transporte intraciliar. En este mismo parásito se observa un tráfico de vesículas hacia un compartimento en la base del flagelo denominado "bolsillo flagelar" en el que se depositan tanto los componentes lipídicos como las proteínas flagelares. Este compartimento persiste en ausencia de flagelo e incluso en ausencia de transporte intraflagelar.[50]
En el resto de los casos parece que las vesículas parecen unirse en la parte inmediatamente próxima al cilio. En vertebrados parece que la proteína Rab8 regul el transporte de proteínas de membrana al cilio. También parecen ser esenciales el componente del transporte intraflagelar IFT20 y su interactuante GMAP210 en el transporte de proteínas (p. ej. Policistina 2) desde el aparato de Golgi a la membrana ciliar.[47]
Axonema[editar]
Los cilios se pueden clasificar de acuerdo a la estructura de su axonema en cuatro grupos básicos:
- móviles con configuración axonémica 9+2,
- móviles 9+0 (cilios nodales),
- cilios sensoriales 9+2 (cilios vestibulares y algunos nodales) y
- cilios sensoriales 9+0 (cilios primarios).
De estas cilias primarias se pueden derivar muchos cilios modificados en estructuras especializadas, como el de los órganos fotorreceptores o los sensilia de insectos.[22][10] Son posibles otras configuraciones de microtúbulos, como 9+1, 9+3 y 9+4.[23]
Cilia primaria[editar]
Las cilias primarias, cilias no móviles o cilias sensoriales (9+0), son únicas en cada célula y se encuentran en la gran mayoría de los tipos celulares. La arquitectura 3D del axonema de la cilia primaria es fundamental para comprender su función sensorial.
En estas cilias no existen como componentes estructurales los rayos radiales (radial spokes en inglés), los enlaces de nexina y los brazos de dineína (dynein arms). Los microtúbulos a lo largo del axonema cambian de dobletes a singletes y la mayoría de ellos terminan antes de llegar a la punta ciliar.[51]
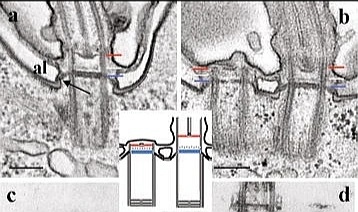
Arriba (ampliación): Axonema (en rojo), Centrosoma (en verde). Lum=lumen Strm=estroma.
En los vertebrados, prácticamente todos los tipos celulares tienen cilios primarios: células epiteliales, células endócrinas, células mesenquimales, músculos, neuronas, células sensoriales.[52] La cilia primaria es el orgánulo que detecta las señales ambientales extracelulares y mediatiza la comunicación de célula a célula. Receptores, canales iónicos y moléculas de señalización celular se expresan de manera alta o diferencial en la cilia primaria.
Control de la morfología y la función[editar]
El complejo 1 del blanco de la rapamicina (complejo Torc1) regula el tamaño y la función de los cilios a través de la síntesis de proteínas. Este mecanismo de regulación está evolutivamente conservado entre las diferentes especies.[53]
La distinción entre estos cilias y flagelos se basa principalmente en su tamaño (unos 12-14 μm), número por célula (suelen ser muchos, con excepción de los cilios primarios y nodales,[14] mientras que los flagelos uno o dos) y en su caso, por el patrón de movimiento (los cilios baten como un remo, son inmóviles o crean un vórtice, mientras que los flagelos no ondulan).
Correspondiendo con estas diferencias estructurales, también existen diferencias funcionales: los flagelos pueden propulsar células móviles en un líquido, mientras que los cilios se sitúan normalmente en células estacionarias, y gracias a su impulso mueven líquidos o elementos contenidos en él. Lo efectúan sincronizando su batido, y generando de ese modo una onda propulsora eficaz al sumarse las fuerzas individuales de cada cilio. Además, los flagelos en ocasiones cuentan, debido a su forma de batido y a su mayor longitud con estructuras específicas para regular los movimientos del axonema y la correcta difusión del ATP, como el bastón flagelar y en insectos un segundo anillo de 9 dobletes de microtúbulos.[54][55]
Movimiento[editar]
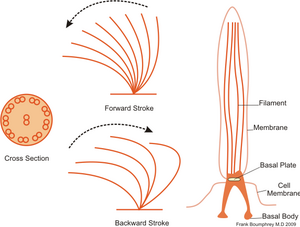
Se mueven rítmicamente y de forma coordinada, cada uno con un movimiento semejante al del brazo de un nadador, retrocediendo en posición extendida, y en conjunto al de un trigal azotado por el viento (movimiento de batida coordinado). Mientras reciban la energía necesaria en forma de ATP los cilios siguen batiendo automáticamente. El efecto es un empuje neto, que da lugar a que la célula se desplace en su medio, como ocurre con ciertos protistas y animales muy pequeños; o que el líquido extracelular circundante sea impulsado, que es la función que cumplen los cilios en el epitelio de las vías respiratorias humanas.
Coordinación y control[editar]
La coordinación de los cilios entre sí, al fustigar el agua sobre la superficie de una célula, viene dada por la misma agua, movida por el cilio precedente. El que sigue en fila halla así una dirección favorecida y se mueve por ella con un pequeño retraso, conducta llamada metacronismo.
El control de los cilios es fundamental en los protozoos ciliados que las emplean para cazar otros protozoos y alimentarse con ellos. Para seguirlos, alcanzarlos, poner su estoma o "boca celular" en posición, retrocediendo si es necesario, para luego comérselos, es menester controlar la natación. Este control se logra por medios eléctricos. Los valores del campo eléctrico en la membrana exterior del protozoo, de donde emergen los cilios o cilias, "dibujan" los movimientos de la presa cercana. Estos le son revelados por las presiones del agua, que interfieren con las oscilaciones u ondas eléctricas que realizan el control.
Su movimiento ayuda también como barrera defensiva a la entrada de microorganismos por las fosas nasales gracias a que están presentes en la mucosa de la nariz y dan forma y ayudan a expulsar el moco.
Ciliogénesis[editar]
Vía acentriolar[editar]
En esta forma de ciliogénesis comienzan con la aparición de gránulos fibrosos de forma irregular en el citoplasma, con un diámetro bastante constante en animales, y que varía de 40-80 nm. Mediante anticuerpos anti-PCM 1 su contenido se ha revelado similar al de los satélites centriolares, y se utilizará posteriormente para la formación de centriolos. Según el tipo celular o el organismo, estos gránulos parecen estar estrechamente relacionados con otros orgánulos, como el aparato de Golgi, el retículo endoplásmico, lamelas anulares o el propio núcleo. Posteriormente estos gránulos se agregan para formar deuterosomas, aunque se ha visto que en algún caso (hámster chino) la formación parece independiente de los gránulos.
Hay dos tipos distintos de deuterososoma: el sólido, con un tamaño de 100-200 nm y el hueco, con un tamaño de unos 700 nm. Su estructura es distinta según la especie. En primates, sólo se observa el de tipo sólido, mientras que en roedores pueden aparecer ambos. Su papel es servir de centro organizador de centriolos y procentriolos. Este último comienza apareciendo como un anillo amorfo procedente de la fusión de gránulos. A partir de esta masa se formará un anillo de nueve microtúbulos simples, que se mantienen unidos por una base en forma de la típica rueda de carro con un eje central y nueve radios. Finalmente, esta estructura se propaga y crecen hasta adquirir la disposición habitual de 9+0 tripletes. El número de centriolos formados de esta manera depende del tamaño del deuterosoma, llegando a superar los nueve en el caso del oviducto del ratón.[56]
Transporte intraflagelar[editar]
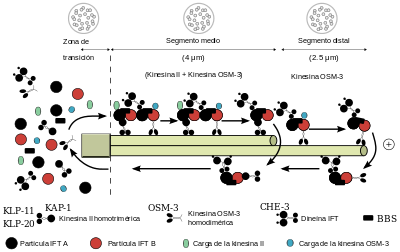
El transporte intraflagelar (IFT, por sus siglas en inglés: Intraflagellar transport) es un proceso celular altamente conservado en la evolución entre eucariotas ciliados, conociéndose pocas excepciones en apicomplejos.[58] Fue caracterizado por primera vez en 1993 utilizando como modelo Chlamydomonas reinhardtii por Keith Kozminski, un estudiante de grado que trabajaba en el laboratorio de Joel Rosenbaum en la Universidad de Yale.[59]
Su función es la siguiente: En el cilio no hay síntesis de proteínas, y el axonema se encuentra bajo inestabilidad dinámica, lo cual significa que su longitud permanece más o menos constante debido a que se añaden en su extremo distal (+) aproximadamente el mismo número de precursores (en especial, monómeros de tubulina y dineína) que se pierden por despolimerización en su extremo distal (-), y crece cuando la velocidad de polimerización supera la de despolimerización. La velocidad de difusión de estos componentes desde el citoplasma, debido a las barreras antes aludidas y a diversos impedimentos espaciales, sería insuficiente para que lleguen en las cantidades adecuadas al polo de crecimiento. Se ha visto que el lugar donde se ensamblan los componentes es el extremo distal.[60] Por ello existe un sistema que selecciona y facilita el transporte de estos y otros componentes. Además, recientemente se ha visto su contribución en otros procesos celulares, como la de señalización celular, el control la división celular y el desarrollo embrionario, así como el momento de inicio de algunas enfermedades.[61] Para hacernos una idea de en que medida sucede esto, pensemos que durante el crecimiento del cilio en Chlamydomonas se precisan unos 200 dímeros de α/Β tubulina por segundo.[62]
El IFT se observó mediante técnicas de microscopía de contraste con videograbación (DIC) como un transporte bidireccional llevado a cabo por un complejo multiproteico, la partícula IFT a lo largo del axonema en el espacio situado entre los dobletes de microtúbulos externos y la membrana ciliar. Esta partícula fue aislada en 1997 por Piperno et al por centrifugación en gradiente de sacarosa, a partir de extractos flagelares de C. reinhardtii, obteniéndose un coeficiente de sedimentación de 16-17 S y formada por 15 polipéptidos.[63] Posteriormente, variando la fuerza iónica se observó que el complejo se podía dividir en dos subcomplejos, llamados IFTA, que consta de 4 polipéptidos, e IFTB, por los 11 restantes.[64]
Se ha visto con microscopía electrónica un número variable de estos complejos con forma de paleta se ensamblan para formar la partícula IFT también denominada a veces "raft" o balsa. Su tamaño es de unos 0,12 micrómetros (μm) en el caso del transporte anterógrado (de la base ciliar al ápice) y de la mitad en el transporte retrógrado. Su espesor es mayor que la distancia entre la membrana y el axonema, por lo que produce un abultamiento de esta última a su paso. Además, cada complejo parecen unidas por fibras entre sí, con la membrana plasmática y con los túbulos B de los dobletes externos. Parece ser que las fibras que se anclan a la membrana podrían estar relacionadas con puentes microtúbulo-membrana que contienen dineína citoplasmática, mientras que los que la unen con el túbulo B serían los motores moleculares.[65]
Se ha propuesto que el ciclo completo tiene lugar en seis pasos:[66]
- Reclutamiento y ensamblaje de los componentes de la partícula IFT junto con su carga en las fibras de transición (láminas alares) de la base del cilio.
- Transporte anterógrado, cargando con la dineína 1b del transporte retrógrado inactivada. OSM-3 realiza el transporte en la parte distal, donde los dobletes externos de microtúbulos se convierte en singletes.
- Comienzo del retorno en el ápice ciliar. Se inactivan las proteínas motoras anterógradas y se desensamblan y descargan las partículas IFT.
- Fin del retorno. Activación del motor retrógrado (dineína 1b) y acoplamiento de la carga de retorno, entre ellas las kinesinas del movimiento anterógrado. Ambos pasos, 3 y 4 son facilitados por la proteína EB-1
- Desensamblaje de la maquinaria IFT en la base del cilio y posible reciclado.
Evolución[editar]
Existen diversas teorías sobre el origen de los undulipodia en eucariotas, a los que en los análisis evolutivos se les suele llamar "cilios" conjuntamente para no crear confusión con los flagelos bacterianos. Estas teorías se pueden clasificar en tres categorías: De origen endosimbionte, de origen viral y de origen en el transporte vesicular o teorías endógenas. La primera hipótesis fue expuesta por Satir en 1961 según esta el cilio habría surgido como un centriolo que acabó uniéndose a la membrana plasmática, confiriendo a la célula ventajas a la hora de responder al medio ambiente. El axonema surgiría posteriormente como un tipo de "aparato mitótico equivocado".[67]
Teorías del origen endosimbionte[editar]
En 1970 Lynn Margulis en su obra "el origen de las células eucariotas" propone que los cilios procederían de un evento de endosimbiosis con organismos semejantes a las espiroquetas, de forma semejante a como los parabasálidos, parásitos de termitas las utilizan hoy en día como órgano de locomoción.[68] A lo largo de su carrera, Margulis, aunque admitió en 1994 que no había ninguna proteína de tipo tubulina en espiroquetas, continuó defendiendo esta teoría, que en su actual formulación afirma que la adquisición de undulipodios en el antepasado común de los eucariotas fue anterior a la presencia de mitocondrias. El primer protista "cariomastigonte" (de karion = núcleo + mastix = látigo o flagelo) se trataría de una quimera que procedería de la fusión de una arquea de tipo Thermoplasma, sin pared celular y resistente ácidos calientes gracias a que su ADN está protegido por proteínas de tipo histona con espiroquetas simbiontes microaerófilas como Leptospira, que buscaban refugio y alimento junto a estas últimas, protegiéndolas de las fluctuaciones en los niveles de oxígeno por la conversión de sulfuro en sulfato, que además puede ser utilizado por las arqueas como aceptor final de la cadena de transporte de electrones. Este organismo desarrolló citoesqueleto, un núcleo formado por la fusión de ambos materiales genéticos que aún permanece vinculado a las proteínas de movilidad. El undulipodio permanecería unido al núcleo por un rizoplasto y un aparato parabasal (Golgi). El ambiente variable donde surgió explicaría la variedad de sensores asociados.[69]
La "teoría de la espiroqueta" cuenta con numerosas críticas, principalmente debido a que no se encuentran homologías estructurales entre los cilios y los aparatos motores de espiroquetas, y la mayor parte de las proteínas esenciales tienen homólogas solo en arqueas.[70][71]
Satir contesta a esta teoría advirtiendo que, además no existe una doble membrana como sería de esperar en el caso endosimbionte, y que las espiroquetas no poseen centriolos.[67]
Otra teoría endosimbionte es la propuesta por Li y Wu. Al contrario que en las espiroquetas, existen homólogos de la tubulina en algunas bacterias de la división Verrucomicrobia, como Epixenosoma. Estos científicos consideran que una bacteria de este tipo pudo ser el endosimbionte en lugar de una espiroqueta.[72]
Teorías de origen viral[editar]
Expuesta por Peter Satir y colaboradores.[19] El primer punto que sugiere un origen viral además de que tiene una formación con apariencia de replicación semiconservativa y está acoplada al ciclo celular y a la mitosis, los centriolos surgen en masa de un centro fibrogranular, de forma muy semejante a como lo hacen los virus. Además existe un ARN asociado que contiene un dominio de transcriptasa inversa típica de retrovirus. Así mismo, se sabe que estos se unen al centrosoma, interfiriendo en ocasiones a sus funciones.
Según Satir, el origen viral explicaría algunos rasgos, como la simetría en nueve ejes y su enantiomorfismo con diferenciación proximal-distal, lo que recuerda las simetrías de placa basal de algunos virus. Se predice que la tectina y otras proteínas "en cinta" serían aportadas por el virus hipotético. Estas proteínas están relacionadas filogenéticamente con los filamentos intermedios y las láminas nucleares, con lo que según la teoría viral, estas proteínas evolucionarían después de la incorporación al genoma del virus.
La secuencia evolutiva que se proponen para el cilio según esta teoría serían la siguiente:[19]
- Un virus de ARN y simetría nonaria invadiría el citoplasma del eucariota primitivo.
- El virus permanecería anclado a la membrana por el collar ciliar primordial y atraería proteínas capaces de proporcionar una señal de posición.
- Se produciría la elongación de la cápside viral utilizando tubulinas y proteínas del IFT ancestral. El primer tipo de cilio que aparecería sería el 9+0
- Aparecería la movilidad del cilio por evolución de dineínas citoplasmáticas para dar los brazos interno y externo del axonema.
- El par central se generaría a partir de microtúbulos citoplasmáticos situados fuera de su lugar habitual, produciendo una movilidad eficiente y ventajosa para el organismo. Surgiría de ese modo el cilio 9+2.
Enfermedades[editar]
Las mutaciones en los genes de proteínas ciliares o de proteínas presentes en la base del cilio o cerca de ella conducen a trastornos (patologías) denominadas ciliopatías:
- enfermedad poliquística renal,
- síndrome de Kartagener,
- síndrome de von Hippel-Lindau,
- síndrome de Laurence-Moon-Bardet-Biedl
entre otras, y también a algunos procesos de
La enfermedad poliquística renal es la más común y afecta a más de 12.5 millones de personas en el mundo. La forma autosómica dominante se encuentra en promedio en ≈1 cada 800 individuos (de 1:400 a 1:1.000).[73] La forma autosómico recesiva afecta a ≈1 cada 20.000-40.000 individuos.
Véase también[editar]
Referencias[editar]
- ↑ OMS,OPS,BIREME (ed.). «Cilio». Descriptores en Ciencias de la Salud. Biblioteca Virtual en Salud.
- ↑ «Voz cilio.». Diccionario de la Real Academia - Vigésima segunda edición. Real Academia Española. 2001. Consultado el 2009.
- ↑ Megías M.; Molist P.; Pombal M.A. «Atlas de histología vegetal y animal».
- ↑ Inglis, Peter N.; Boroevich, Keith A.; Leroux, Michel R. (septiembre de 2006). «Piecing together a ciliome». Trends Genet (en inglés) (Elsevier) 22 (9): 491-500. PMID 16860433. «finding the intersection between the ciliated human and Chlamydomonas genomes and subtracting the non-ciliated Arabidopsis genome. This yielded a so-called flagellar apparatus-basal body (FABB) proteome containing 688 proteins».
- ↑ a b c Satir, Peter; Christensen, Soren Tvorup (2007-03). «Overview of Structure and Function of Mammalian Cilia». Annu. Rev. Physiol (REVISIÓN) (en inglés) 69: 377-400. PMID 17009929.
- ↑ Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts y Peter Walter. (2002). Molecular Biology of The Cell (HTML) (en inglés) (4ª edición). Consultado el 26 de febrero de 2009.
- ↑ a b Frixione, Eugenio (2000). De motu proprio: Una historia de la fisiología del movimiento. Siglo XXI. pp. 70-71. ISBN 968232226X. Consultado el 27 de febrero de 2009.
- ↑ Purkinje,JE y Valentin, G (1835) De phaenomeno generali et fundamentali motus vibratorii continui in membranis cum externis tum internis animalium plurimorum et superiorum et inferiorum ordinum obviii. Commentatio Physiologica. Wratislaviae, p96
- ↑ Chapman, MJ; Dolan MF, Margulis L. (diciembre de 2002). «Centrioles and kinetosomes: form, function, and evolution». Q. Rev. Biol. (en inglés) 75 (4): 409-29. PMID 11125699.
- ↑ a b c d e f g Satir, Peter; Christensen, Søren T. (2008). «Structure and function of mammalian cilia». Histochem Cell Biol. (en inglés) (Springer Verlag) 129 (6). PMID 18365235 doi 10.1007/s00418-008-0416-9. Consultado el 27 de febrero de 2009.
- ↑ a b Whalley, Katherine (diciembre de 2008). «Millestone 4:(1965) Dynein, the first microtubule-dependent motor». Nature Millestones: Cytoskeleton (en inglés). doi:10.1038/nrm2558. Consultado el 7 de marzo de 2009.
- ↑ Jermy, Andrew (diciembre de 2008). «Millestone 15: Brand New Motor». Nature Millestones: Cytoskeleton (en inglés). doi:10.1038/nrm2570. Consultado el 7 de marzo de 2009.
- ↑ Lynn, Margulis; Heather I. McKhann, Lorraine Olendzenski (1993). «Introducción». Illustrated Glossary of Protoctista: Vocabulary of the Algae, Apicomplexa, Ciliates, Foraminifera, Microspora, Water Molds, Slime Molds, and the Other Protoctists (en inglés). pp. xviii. ISBN 0867200812. Consultado el 26 de febrero de 2009.
- ↑ a b Beertsen, W; Everts V, Houtkooper JM. (noviembre de 1975). «Frequency of occurrence and position of cilia in fibroblasts of the periodontal ligament of the mouse incisor». Cell Tissue Res. (en inglés) (Springer Verlag) 163 (4). PMID 1201585. doi:10.1007/BF00218489. Consultado el 27 de febrero de 2009.
- ↑ a b c Michael H. Ross; Wojciech Pawlina (2007). «5:Tejido epitelial». Histología: texto y atlas color con biología celular y molecular (5ª edición). Médica Panamericana. pp. 114-119.
- ↑ Rizzotti, Martino (2000). Early Evolution: From the Appearance of the First Cell to the First Modern Organisms (en inglés). Birkhäuser. p. 100. ISBN 3764361913. Consultado el 26 de febrero de 2009.
- ↑ Ogura, Y (26 de octubre). «History of discovery of spermatozoids in Ginkgo biloba and Cycas revoluta» (en inglés). Archivado desde el original el 26 de septiembre de 2015. Consultado el 26 de febrero de 2009.
- ↑ Marshall, Wallace F. (febrero de 2009). «Centriole evolution». Curr Opin Cell Biol. (en inglés) (Willey InterScience) 21 (1): 14-9. PMID 19196504. doi:10.1016/j.ceb.2009.01.008.
- ↑ a b c d Satir, Peter; Guerra, Charles; Bell, Aaron (2007-12). «Evolution and Persistence of the Cilium». Cell Motil Cytoskeleton. (en inglés) 64 (12): 906-913. PMID 17896340. doi:10.1002/cm.20238.
- ↑ Whitfield, James F. (mayo de 2003). «Primary cilium - is it an osteocyte's strain-sensing flowmeter?». J Cell Biochem. (en inglés) (Willey InterScience) 89 (2). PMID 12704786 doi 10.1002/jcb.10509.
- ↑ Mitchell, Brian; Jacobs R.; Li J.; Chien S.; Kintner C. (2007). «A positive feedback mechanism governs the polarity and motion of motile cilia». Nature (en inglés) (Nature Publishing Group,) 447 (7140): 97-101. doi:10.1038/nature05771. PMID 17450123. Consultado el 27 de febrero de 2009.
- ↑ a b Hoyer-Fender, Sigrid. «Functional analyses of the primary cilium» (en inglés). Universidad de Gotinga, Facultad de Biología, Departamento de biología del desarrollo. Consultado el 28 de marzo de 2009.
- ↑ a b Feistel, Kerstin; Blum, Martin (diciembre de 2006). «Three types of cilia including a novel 9+4 axoneme on the notochordal plate of the rabbit embryo». Dev Dyn. (en inglés) (Willey Interscience) 235 (12). PMID 17061268. doi:10.1002/dvdy.20986. Consultado el 27 de febrero de 2009.
- ↑ a b William, Dentler; Witman, George (1995). «38 "High-resolution imaging of flagella"». Methods in Cell Biology: Cilia and Flagella (Google Books) (en inglés). Academic Press. pp. 263-87. ISBN 0125641486. Consultado el 3 de marzo de 2009.
- ↑ Plaza Valía, P; Carrión Valero F, Marín Pardo J, Bautista Rentero D, González Monte C. (octubre de 2008). «Saccharin test for the study of mucociliary clearance: reference values for a Spanish population». Arch Broconeumol 44 (10): 5540-5. PMID 19006634 doi:10.1016/S1579-2129(08)60100-7. Consultado el 3 de marzo de 2009.
- ↑ Awan, A; Bernstein M, Hamasaki T, Satir P. (mayo de 2004). «Cloning and characterization of Kin5, a novel Tetrahymena ciliary kinesin II». Cell Motil Cytoskeleton. (en inglés) (Wiley InterScience) 58 (1): 1-9. PMID 14983519. Consultado el 8 de marzo de 2009.
- ↑ Wu, R; Zhao YH, Chang MM. (octubre de 1997). «Growth and differentiation of conducting airway epithelial cells in culture». Eur Respir J (en inglés) 10 (10): 2398-403. PMID 9387971.
- ↑ Whitcutt, MJ; Adler KB, Wu R. (mayo de 1988). «A biphasic chamber system for maintaining polarity of differentiation of cultured respiratory tract epithelial cells». In Vitro Cell Dev Biol (en inglés) 24 (5): 420-8. PMID 3372447. Consultado el 4 de marzo de 2009.
- ↑ Bals, R; Beisswenger C, Blouquit S, Chinet T. (agosto de 2004). «Isolation and air-liquid interface culture of human large airway and bronchiolar epithelial cells». J Cyst Fibros. (en inglés) (3 supp 2): 49-51. PMID 15463925 doi:10.1016/j.jcf.2004.05.010. Consultado el 6 de marzo de 2009.
- ↑ Yamaya, M; Hosoda M, Suzuki T, Yamada N, Sasaki H. (marzo de 2002). «Human airway epithelial cell culture». Methods Mol Biol (en inglés) (188): 7-16. PMID: 11987563 doi:10.1385/1-59259-185-X:07. Consultado el 6 de marzo de 2009.
- ↑ Kim, WJ; Han TH, Kim HJ, Park RW. (2007). «Optical flow techniques with peak detection method for ciliary beat frequency measurement.». AMIA Annu Symp Proc. (en inglés) 11 (1069). PMID 18694167.
- ↑ Sciphor, I; Palmer JN, Cohen AS, Cohen NA. (enero-febrero de 2006). «Quantification of ciliary beat frequency in sinonasal epithelial cells using differential interference contrast microscopy and high-speed digital video imaging». Am J Rhinol (en inglés) 20 (1): 124-7. PMID 16539308.
- ↑ Sanders, MA; Salisbury, JL (1995). «Immunofluorescence microscopy of cilia and flagella». Methods Cell Biol (en inglés) (Academic Press) (47): 163-9. PMID 7476482.
- ↑ Deane, JA; Cole DG, Seeley ES, Diener DR, Rosenbaum JL (octubre de 2001). «Localization of intraflagellar transport protein IFT52 identifies basal body transitional fibers as the docking site for IFT particles». Curr Biol (en inglés) 11 (20): 1586-90. PMID 11676918 doi:10.1016/S0960-9822(01)00484-5. Consultado el 12 de marzo de 2009.
- ↑ Lučić, Vladan; Andrew Leis y Wolfgang Baumeister (agosto de 2008). «Cryo-electron tomography of cells: connecting structure and function». Histochem Cell Biol. (en inglés) 130 (2): 185-96. PMID 18566823. Consultado el 9 de marzo de 2009.
- ↑ di Fiore, Mariano SH; Eroschenko, Victor P (2007). Di Fiore's Atlas of Histology with Functional Correlations (en inglés). Lippincott Williams & Wilkins. pp. 30-31. ISBN 0781770572.
- ↑ A. Ortiz (2004). «Cilios y cistogénesis» (PDF). Nefrología XXIV (4): 307.
- ↑ Megías M.; Molist P.; Pombal M.A. «Cilios y Flagelos. Ampliaciones. La célula.». Atlas de histología vegetal y animal.
- ↑ Fernández-Álvarez M. (2021). Cilio primario y ciliopatías (Tesis). Facultad de Medicina. Universidad de Cantabria.
- ↑ Afahel, E.; Korngreen, A.; Parola, A.H.; Priel, Z. (1996). «Purinergically induced membrane fluidization in ciliary cells: characterization and control by calcium and membrane potential». Biophys Journal (en inglés) 70 (2): 1045-53. PMID 8789123. Consultado el 17 de marzo de 2009.
- ↑ Mewe M.; Tielker D.; Schönberg R.; Schachner M.; Jaeger K.E.; Schumacher U. (2005). «Pseudomonas aeruginosa lectins I and II and their interaction with human airway cilia.». J Laryngol Otol (en inglés) 119 (8): 595-9. PMID 16102212. Consultado el 26 de abril de 2009.
- ↑ Maerker T.; van Wijk E.; Overlack N.; Kersten F.F.; McGee J.; Goldmann T.; Sehn E.; Roepman R. ; Walsh E.J. ; Kremer H. ; Wolfrum U. (2008). «A novel Usher protein network at the periciliary reloading point between molecular transport machineries in vertebrate photoreceptor cells». Hum. Mol. Genet. (en inglés) 17 (1): 71-86. PMID 17906286 doi:10.1093/hmg/ddm285. Consultado el 16 de marzo de 2009.
- ↑ a b Jena, Bhanu P (2008). Methods in Nano Cell Biology (google books) (en inglés). Academic Press. p. 148. ISBN 1597492701. Consultado el 3 de mayo de 2009.
- ↑ Vieira, OV; Gaus K, Verkade P, Fullekrug J, Vaz WL, Simons K. (diciembre de 2008). «FAPP2, cilium formation, and compartmentalization of the apical membrane in polarized Madin-Darby canine kidney (MDCK) cells». Proc Natl Acad Sci U S A. (en inglés) 103 (49): 18556-61. PMID 17116893 doi: 10.1073/pnas.0608291103. Consultado el 16 de marzo de 2009.
- ↑ Mitchell, DR (diciembre de 2004). «Speculations on the evolution of 9+2 organelles and the role of central pair microtubules». Biol Cell (en inglés) 96 (9): 691-6. PMID 15567523. doi:10.1016/j.biolcel.2004.07.004.
- ↑ Avidor-Reiss, Tomer; Andreia M Maer,Edmund Koundakjian,Andrey Polyanovsky,Thomas Keil,Shankar Subramaniam y Charles S Zuker (mayo de 2004). «Decoding cilia function: defining specialized genes required for compartmentalized cilia biogenesis». Cell (en inglés) 117 (4): 527-39. PMID 15137945. doi:10.1016/S0092-8674(04)00412-X.
- ↑ a b Follit, JA; San Agustin JT, Xu F, Jonassen JA, Samtani R, Lo CW, Pazour GJ. (diciembre de 2008). «The Golgin GMAP210/TRIP11 anchors IFT20 to the Golgi complex». PLoS Genetics (en inglés) 4 (12). PMID 19112494 doi:10.1371/journal.pgen.1000315. Consultado el 1 de abril de 2009.
- ↑ A., Kubo; Yuba-Kubo A, Tsukita S, Tsukita S, Amagai M. (diciembre de 2008). «Sentan: a novel specific component of the apical structure of vertebrate motile cilia». Mol Biol Cell (en inglés) 19 (12): 5338-46. PMID 18829862. doi:10.1091/mbc.E08-07-0691. Consultado el 26 de abril de 2009.
- ↑ Foliquet, B.; Puchelle, B (enero-febrero de 1986). «Apical structure of human respiratory cilia». Bull Eur Physiopathol Respir. (en inglés) 22 (1): 43-47. PMID 3697548.
- ↑ Absalon, S.; Blisnick T, Kohl L, Toutirais G, Doré G, Julkowska D, Tavenet A, Bastin P. (marzo de 2008). «Intraflagellar transport and functional analysis of genes required for flagellum formation in trypanosomes». Mol Biol Cell. (en inglés) 19 (3): 929-44. PMID 18094047 doi: 10.1091/mbc.E07-08-0749. Consultado el 1 de abril de 2009.
- ↑ Sun S.; Fisher R.L.; Bowser S.S.; Pentecost B.T.; Sui H. (7 de mayo de 2019). «Three-dimensional architecture of epithelial primary cilia». Proc Natl Acad Sci USA 116 (19): 9370-9379. PMC 6511023. PMID 31004057. doi:10.1073/pnas.1821064116. Consultado el 10 de mayo de 2023.
- ↑ Pablos M.; Casanueva-Álvarez E.; González-Casimiro C.M.; Merino B.; Perdomo G.; Cózar-Castellano I. (2022). «Primary Cilia in Pancreatic β- and α-Cells: Time to Revisit the Role of Insulin-Degrading Enzyme». Frontiers in Endocrinology (Lausanne) (REVISIÓN). Sec. Diabetes: Molecular Mechanisms 13 (922825). PMC 9271624. PMID 35832432. Consultado el 9 de mayo de 2023.
- ↑ Yuan, S.; J. Li, D. R. Diener, M. A. Choma, J. L. Rosenbaum, Z. Sun (23 de enero de 2012). «From the Cover: Target-of-rapamycin complex 1 (Torc1) signaling modulates cilia size and function through protein synthesis regulation». Proceedings of the National Academy of Sciences (en inglés) 109 (6): 2021-2026. ISSN 1091-6490. doi:10.1073/pnas.1112834109. Consultado el 13 de febrero de 2012.
- ↑ Lewin, Benjamin; Lynne Cassimeris, Vishwanath R. Lingappa, M.D., George Plopper (2007). «7». Cells (en inglés). Jones & Bartlett Publishers. pp. 356-358. ISBN 0763739057. Consultado el 26 de febrero de 2009.
- ↑ Portman, Neil; Lacomble S, Thomas B, McKean PG, Gull K. (febrero de 2009). «Combining RNA interference mutants and comparative proteomics to identify protein components and dependences in a eukaryotic flagellum». J Biol Chem. (en inglés) 284 (9): 5610-5619. PMID 19074134. doi:10.1074/jbc.M808859200. Consultado el 20090421.
- ↑ Hagiwara, Haruo; Ohwada, Nobuo y Takata, Kuniaki (2004). «Cell Biology of Normal and Abnormal Ciliogenesis in the Ciliated Epithelium». En Kwang J Jeon, ed. International Review Of Cytology: A Survey of Cell Biology (en inglés) 234. Academic Press. pp. 105-108. ISBN 0123646383. Consultado el 7 de marzo de 2009.
- ↑ Inglis, PN et al. (marzo de 2007). «The sensory cilia of Caenorhabditis elegans» (en inglés). Wormbook.org. Consultado el 4 de abril de 2009.
- ↑ Briggs, Laura J; Davidge JA, Wickstead B, Ginger ML, Gull K. (agosto de 2004). More than one way to build a flagellum: comparative genomics of parasitic protozoa (en inglés) 14 (15). pp. R611-2. PMID 15296774. doi:10.1016/j.cub.2004.07.041. Consultado el 26 de abril de 2009.
- ↑ Kozminski, Keith; Johnson KA, Forscher P, Rosenbaum JL. (junio de 1993). «A motility in the eukaryotic flagellum unrelated to flagellar beating». Proc Natl Acad Sci U S A. (en inglés) 90 (12): 5519-23. PMID 8516294. Consultado el 26 de abril de 2009.
- ↑ Rosenbaum, JL.; Cole DG, Diener DR. (febrero de 1999). «Intraflagellar Transport: The Eyes Have It». J Cell Biol (en inglés) 144 (3): 385-8. PMID 9971734. Consultado el 3 de mayo de 2009.
- ↑ Scholey, Johnatan M (enero de 2008). «Intraflagellar transport motors in cilia: moving along the cell's antenna». J Cell Biol (en inglés) 180 (1): 103-9. PMID 18180368. doi:10.1083/jcb.200709133. Consultado el 3 de mayo de 2008.
- ↑ Whitman, George; Harris, Elizabeth H (2008). «4: Intraflagellar transport» (Google books). The Chlamydomonas Sourcebook. 3: Cell Motility and Behaviour (2 edición). Academic Press. p. 72. ISBN 0123708761. Consultado el 26 de abril de 2009.
- ↑ Piperno, Gianni; Mead, Kara (abril de 1997). «Transport of a novel complex in the cytoplasmic matrix of Chlamydomonas flagella». Proc Natl Acad Sci U S A. (en inglés) 94 (9): 4457-62. PMID 9114011. Consultado el 3 de abril de 2009.
- ↑ Cole, DG; Diener DR, Himelblau AL, Beech PL, Fuster JC, Rosenbaum JL. (mayo de 1997). «Chlamydomonas kinesin-II-dependent intraflagellar transport (IFT): IFT particles contain proteins required for ciliary assembly in Caenorhabditis elegans sensory neurons». J Cell Biol (en inglés) 141 (4): 993-1008. PMID 9585417. Consultado el 3 de mayo de 2009.
- ↑ William, Dentler (agosto de 2005). «Intraflagellar transport (IFT) during assembly and disassembly of Chlamydomonas flagell». J Cell Biol. (en inglés) 170 (4): 649-59. PMID 16103230. doi:10.1083/jcb.200412021. Consultado el 3 de mayo de 2009.
- ↑ Pedersen, Lotte B.; Veland IR, Schrøder JM, Christensen ST. (agosto de 2008). «Assembly of Primary Cilia». Dev dyn (en inglés) (85): 23-61. PMID 19147001. doi:10.1002/dvdy.21521.
- ↑ a b Satir, Peter (febrero de 1961). «Cilia». Sci Am (en inglés) (204): 108-116. PMID 13746697.
- ↑ Lynn, Margullis (febrero de 1971). Origin of Eukaryotic Cells (en inglés). Yale University Press. p. 371. ISBN 978-0300013535.
- ↑ Margulis, Lynn; Chapman M, Guerrero R, Hall J. (agosto de 2006). «The last eukaryotic common ancestor (LECA): acquisition of cytoskeletal motility from aerotolerant spirochetes in the Proterozoic Eon». Proc Natl Acad Sci U S A. (en inglés) 103 (35): 13080-5. PMID 16938841. doi:10.1073/pnas.0604985103. Consultado el 21 de abril de 2009.
- ↑ H, Hartman; Smith TF. (abril de 2009). «The evolution of the cilium and the eukaryotic cell». Cell Motil Cytoskeleton. (en inglés) (Willey InterScience) 66 (4): 215-9. PMID 19253335. doi:10.1002/cm.20344.
- ↑ JY, Li; Wu, CF (agosto de 2003). «Perspectives on the origin of microfilaments, microtubules, the relevant chaperonin system and cytoskeletal motors--a commentary on the spirochaete origin of flagella». Cell Res (en inglés) (Nature publishing group) 13 (4): 219-27. PMID 12974612. doi:10.1038/sj.cr.7290167. Consultado el 21 de abril de 2009.
- ↑ JY, Li; Wu, CF (julio de 2005). Naturwissenschaften (en inglés) 92 (7): 305-9. PMID 15905978. doi:10.1007/s00114-005-0635-z.
- ↑ Irazabala M.V.; Torres V.E. (2011). «Poliquistosis renal autosómica dominante». Nefrogenética 2 (1): 1-119. doi:10.3265/NefrologiaSuplementoExtraordinario.pre2011.Mar.10905.
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Cilio.
Wikimedia Commons alberga una categoría multimedia sobre Cilio.- Cilios y cistogénesis (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).. Artículo en español de la revista Nefrología de la Universidad Autónoma de Madrid y el Instituto Reina Sofía de Investigación Nefrológica. Buena comparación entre cilios móviles y primarios.
- Ciliome.com Página de la Universidad Simon Fraser de Canadá con numerosos recursos para investigadores, incluyendo una base de datos sobre proteínas implicadas en la función ciliar.
- Video que muestra el transporte intraflagelar (IFT) en Chlamydomonas bajo DIC e inmunofluorescencia.
- Lista actualizada de tipos celulares de mamíferos que poseen cilios primarios. Dr. Bowser en colaboración con el Dr. Wheatley.