Adherencia celular
La adherencia celular o adhesión celular es la capacidad que tienen las células pluricelulares de unirse a elementos del medio externo o a otras células. La adhesión celular se produce tanto por fuerzas electrostáticas y otras interacciones inespecíficas como por moléculas de adhesión celular, que son específicas.
La adhesión celular se produce a partir de las interacciones entre moléculas de adhesión celular (CAM por sus siglas en inglés),[1] proteínas transmembrana situadas en la superficie celular. La adhesión celular une a las células de diferentes maneras y puede estar implicada en la transducción de señales para que las células detecten y respondan a cambios en el entorno.[2][3] Otros procesos celulares regulados por la adhesión celular incluyen la migración celular y el desarrollo de tejidos en organismos multicelulares[4] Las alteraciones en la adhesión celular pueden interrumpir procesos celulares importantes y provocar diversas enfermedades, como cáncer[5][6] y artritis.[7] La adhesión celular también es esencial para que organismos infecciosos, como bacterias o virus, causen enfermedades.[8][9]
La adherencia celular está relacionada con múltiples funciones celulares como son:
- El desarrollo embrionario.
- La migración celular.
- La comunicación celular.
- La diferenciación celular.
- El desarrollo del cáncer.
Entre las uniones celulares de vertebrados destacan: los desmosomas, las uniones adherentes, uniones estrechas y uniones gap.
Mecanismo general
[editar]
Las CAM se clasifican en cuatro grandes familias: integrinas, superfamilia de inmunoglobulinas (Ig), cadherinas y selectinas.[1] Las cadherinas y las IgSF son CAM homófilas, ya que se unen directamente al mismo tipo de CAM en otra célula, mientras que las integrinas y las selectinas son CAM heterofílicas que se unen a diferentes tipos de CAM.[1] Cada una de estas moléculas de adhesión tiene una función diferente y reconoce diferentes ligandos. Los defectos en la adhesión celular suelen atribuirse a defectos en la expresión de las CAM.
En los organismos pluricelulares, las uniones entre las CAM permiten que las células se adhieran entre sí y crean estructuras denominadas uniones celulares. Según sus funciones, las uniones celulares pueden clasificarse en:[2]
- Uniones de anclaje (uniones adherentes, desmosomas y hemidesmosomas), que mantienen unidas a las células y refuerzan el contacto entre ellas.
- Uniones oclusivas (uniones estrechas), que sellan los huecos entre las células a través del contacto célula-célula, creando una barrera impermeable para la difusión.
- Uniones formadoras de canales (gap junctions), que unen el citoplasma de células adyacentes permitiendo el transporte de moléculas entre las células.
- Uniones de transmisión de señales, que pueden ser sinapsis en el sistema nervioso.
Alternativamente, las uniones celulares pueden clasificarse en dos tipos principales en función de lo que interactúa con la célula: uniones célula-célula, mediadas principalmente por cadherinas, y uniones célula-matriz, mediadas principalmente por integrinas.
Uniones célula-célula
[editar]Las uniones célula-célula pueden presentarse de diferentes formas. En las uniones de anclaje entre células, como las uniones adherentes y los desmosomas, las principales CAM presentes son las cadherinas. Esta familia de CAMs son proteínas de membrana que median la adhesión célula-célula a través de sus dominios extracelulares y requieren iones Ca2+ extracelulares para funcionar correctamente.[1] Las cadherinas forman uniones homofílicas entre ellas, lo que da lugar a que células de un tipo similar se adhieran entre sí y puede dar lugar a una adhesión celular selectiva, que permite a las células de los vertebrados reunirse en tejidos organizados.[2] Las cadherinas son esenciales para la adhesión célula-célula y la señalización celular en animales pluricelulares y pueden dividirse en dos tipos: cadherinas clásicas y cadherinas no clásicas.[1]
Uniones adherentes
[editar]
La función principal de las uniones adherentes es mantener la forma de los tejidos y mantener unidas las células. En las uniones adherentes, las cadherinas entre células vecinas interactúan a través de sus dominios extracelulares, que comparten una región conservada sensible al calcio en sus dominios extracelulares. Cuando esta región entra en contacto con iones Ca2+, los dominios extracelulares de las cadherinas experimentan un cambio de conformación, pasando de la conformación flexible inactiva a una conformación más rígida, con el fin de someterse a la unión homofílica. Los dominios intracelulares de las cadherinas también están muy conservados, ya que se unen a proteínas llamadas cateninas, formando complejos catenina-cadherina. Estos complejos proteicos unen las cadherinas a los filamentos de actina. Esta asociación con los filamentos de actina es esencial para que las uniones adherentes estabilicen la adhesión célula-célula.[10][11][12] Las interacciones con los filamentos de actina también pueden promover la agrupación de cadherinas, que participan en el ensamblaje de las uniones adherentes. Esto se debe a que las agrupaciones de cadherinas promueven la polimerización de los filamentos de actina, lo que a su vez favorece el ensamblaje de las uniones adherentes al unirse a los complejos cadherina-catenina que se forman en la unión.
Desmosomas
[editar]Los desmosomas son estructuralmente similares a las uniones adherentes, pero están formados por componentes diferentes. En lugar de las cadherinas clásicas, actúan como moléculas de adhesión cadherinas no clásicas como las desmogleínas y las desmocolinas, que están unidas a filamentos intermedios en lugar de a filamentos de actina.[13] En los desmosomas no hay catenina, ya que los dominios intracelulares de las cadherinas desmosómicas interactúan con las proteínas de la placa desmosómica, que forman las gruesas placas citoplasmáticas de los desmosomas y unen las cadherinas a los filamentos intermedios.[14] Los desmosomas proporcionan fuerza y resistencia a la tensión mecánica descargando fuerzas sobre los filamentos intermedios flexibles pero resistentes, algo que no puede ocurrir con los filamentos rígidos de actina.[13] Esto hace que los desmosomas sean importantes en los tejidos que se enfrentan a altos niveles de estrés mecánico, como el músculo cardíaco y los epitelios, y explica por qué aparece con frecuencia en este tipo de tejidos.
Uniones estrechas
[editar]Las uniones estrechas están normalmente presentes en los tejidos epiteliales y endoteliales, donde sellan huecos y regulan el transporte paracelular de solutos y fluidos extracelulares en estos tejidos que funcionan como barreras.[15] Las uniones estrechas están formadas por proteínas transmembrana, como claudinas, ocludinas y tricelulinas, que se unen estrechamente entre sí en membranas adyacentes de forma homofílica.[2] De forma similar a las uniones de anclaje, los dominios intracelulares de estas proteínas de la unión estrecha se unen a proteínas de andamiaje que mantienen estas proteínas en grupos y las unen a filamentos de actina para mantener la estructura de la unión estrecha.[16] Las claudinas, esenciales para la formación de las uniones estrechas, forman poros paracelulares que permiten el paso selectivo de iones específicos a través de las uniones estrechas, haciendo que la barrera sea selectivamente permeable.[15]
Uniones gap
[editar]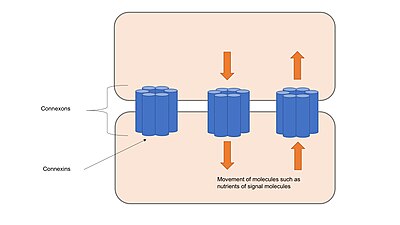
Las uniones gap están formadas por canales denominados conexonas, que consisten en proteínas transmembrana denominadas anexinas agrupadas en grupos de seis.[17] Las conexonas de células adyacentes forman canales continuos cuando entran en contacto y se alinean entre sí. Estos canales permiten el transporte de iones y pequeñas moléculas entre el citoplasma de dos células adyacentes, además de mantener las células unidas y proporcionar estabilidad estructural como las uniones de anclaje o uniones estrechas.[2] Los canales de las uniones gap son selectivamente permeables a iones específicos dependiendo de qué conexinas formen las conexonas, lo que permite que las uniones gap participen en la señalización celular regulando la transferencia de moléculas implicadas en las cascadas de señalización.[18] Los canales pueden responder a muchos estímulos diferentes y se regulan dinámicamente mediante mecanismos rápidos, como la compuerta de voltaje, o lentos, como la alteración del número de canales presentes en las uniones gap.[17]
Adhesión mediada por selectinas
[editar]Las selectinas son una familia de CAM especializadas que intervienen en la adhesión transitoria célula-célula que se produce en el sistema circulatorio. Median principalmente el movimiento de los glóbulos blancos (leucocitos) en el torrente sanguíneo al permitir que los glóbulos blancos "rueden" sobre las células endoteliales mediante uniones reversibles de selectinas.[19] Las selectinas sufren uniones heterofílicas, ya que su dominio extracelular se une a los carbohidratos de las células adyacentes en lugar de a otras selectinas, mientras que también requieren iones Ca2+ para funcionar, al igual que las cadherinas.[2] La adhesión celular de los leucocitos a las células endoteliales es importante para las respuestas inmunitarias, ya que los leucocitos pueden desplazarse a los focos de infección o lesión a través de este mecanismo.[20] En estos lugares, las integrinas de los leucocitos rodantes se activan y se unen firmemente a las células endoteliales locales, lo que permite que los leucocitos dejen de migrar y se desplacen a través de la barrera endotelial.[20]
Adhesión mediada por miembros de la superfamilia de las inmunoglobulinas
[editar]La superfamilia de las inmunoglobulinas (IgSF) es una de las mayores superfamilias de proteínas del organismo y contiene muchas CAM diversas implicadas en diferentes funciones. Estas proteínas transmembrana tienen uno o más dominios similares a las inmunoglobulinas en sus dominios extracelulares y se unen a ligandos de células adyacentes de forma independiente del calcio.[21] Algunas IgSF CAM, como las moléculas de adhesión celular neural (NCAM), pueden realizar uniones homofílicas, mientras que otras, como las moléculas de adhesión celular intercelular (ICAM) o las moléculas de adhesión celular vascular (VCAM), experimentan uniones heterofílicas con moléculas como carbohidratos o integrinas.[22] Tanto las ICAM como las VCAM se expresan en las células endoteliales vasculares e interactúan con las integrinas de los leucocitos para facilitar su adhesión y su movimiento a través de la barrera endotelial.[22]
Uniones célula-matriz
[editar]Las células crean matriz extracelular liberando moléculas en el espacio extracelular que las rodea. Las células tienen CAM específicas que se unen a las moléculas de la matriz extracelular y unen la matriz al citoesqueleto intracelular.[2] La matriz extracelular puede actuar como soporte al organizar las células en tejidos y también puede participar en la señalización celular al activar vías intracelulares cuando se une a las CAM.[1]
Las uniones célula-matriz están mediadas principalmente por integrinas, que también se agrupan como cadherinas para formar adhesiones firmes. Las integrinas son heterodímeros transmembrana formados por diferentes subunidades α y β, ambas subunidades con diferentes estructuras de dominio.[23] Las integrinas pueden señalizar en ambas direcciones: la señalización de dentro a fuera, señales intracelulares que modifican los dominios intracelulares, puede regular la afinidad de las integrinas por sus ligandos, mientras que la señalización de fuera a dentro, ligandos extracelulares que se unen a los dominios extracelulares, puede inducir cambios conformacionales en las integrinas e iniciar cascadas de señalización.[23] Los dominios extracelulares de las integrinas pueden unirse a distintos ligandos mediante uniones heterofílicas, mientras que los dominios intracelulares pueden unirse a filamentos intermedios, formando hemidesmosomas, o a filamentos de actina, formando adhesiones focales.[24]
Hemidesmosomas
[editar]
En los hemidesmosomas, las integrinas se unen a proteínas de la matriz extracelular denominadas lamininas en la lámina basal, que es la matriz extracelular secretada por las células epiteliales.[2] Las integrinas unen la matriz extracelular a los filamentos intermedios de queratina, que interactúa con el dominio intracelular de las integrinas a través de proteínas adaptadoras como las plectinas y la BP230.[25] Los hemidesmosomas son importantes para mantener la estabilidad estructural de las células epiteliales anclándolas entre sí indirectamente a través de la matriz extracelular.
Adherencias focales
[editar]En las adhesiones focales, las integrinas unen las fibronectinas, un componente de la matriz extracelular, a los filamentos de actina del interior de las células.[24] Las proteínas adaptadoras, como las talinas, vinculinas, α-actininas y filaminas, forman un complejo en el dominio intracelular de las integrinas y se unen a los filamentos de actina.[26] Este complejo multiproteico que une las integrinas a los filamentos de actina es importante para el ensamblaje de complejos de señalización que actúan como señales para el crecimiento y la motilidad celular.[26]
Otros organismos
[editar]Eucariotas
[editar]Las células vegetales se adhieren estrechamente entre sí y se conectan a través de plasmodesmos, canales que atraviesan las paredes celulares de las plantas y conectan los citoplasmas de células vegetales adyacentes.[27] Las moléculas que son nutrientes o señales necesarias para el crecimiento se transportan, de forma pasiva o selectiva, entre las células vegetales a través de los plasmodesmos.[27]
Los protozoos expresan múltiples moléculas de adhesión con diferentes especificidades que se unen a los carbohidratos situados en las superficies de sus células huésped.[28] La adhesión célula-célula es clave para que los protozoos patógenos se adhieran y entren en sus células huésped. Un ejemplo de protozoo patógeno es el parásito de la malaria (Plasmodium falciparum),[29] que utiliza una molécula de adhesión llamada proteína del circumsporozoito para unirse a las células hepáticas y otra molécula de adhesión llamada proteína de superficie del merozoito para unirse a los glóbulos rojos.[30]
Los hongos patógenos utilizan moléculas de adhesión presentes en su pared celular para unirse,mediante interacciones proteína-proteína o proteína-carbohidrato, a las células del huésped[31] o a las fibronectinas de la matriz extracelular.[32]
Procariotas
[editar]Los procariotas tienen moléculas de adhesión en su superficie celular denominadas adhesinas bacterianas, además de utilizar sus pili (fimbrias) y flagelos para la adhesión celular.[8] Las adhesinas pueden reconocer diversos ligandos presentes en la superficie de la célula huésped y también componentes de la matriz extracelular. Estas moléculas también controlan la especificidad del huésped y regulan el tropismo (interacciones específicas con tejidos o células) mediante la interacción con sus ligandos.[33]
Virus
[editar]Los virus también tienen moléculas de adhesión necesarias para la unión viral a las células huésped. Por ejemplo, el virus de la gripe tiene una hemaglutinina en su superficie que es necesaria para el reconocimiento del azúcar ácido siálico en las moléculas de la superficie de la célula huésped.[34] El VIH tiene una molécula de adhesión denominada gp120 que se une a su ligando CD4, que se expresa en los linfocitos.[35] Los virus también pueden dirigirse a los componentes de las uniones celulares para entrar en las células huésped, como ocurre cuando el virus de la hepatitis C se dirige a las ocludinas y claudinas de las uniones estrechas para entrar en las células hepáticas.[9]
Implicaciones clínicas
[editar]La disfunción de la adhesión celular se produce durante la metástasis del cáncer. La pérdida de adhesión célula-célula en las células tumorales metastásicas les permite escapar de su lugar de origen y diseminarse por el sistema circulatorio.[5] Un ejemplo de CAM desregulada en el cáncer son las cadherinas, que se inactivan por mutaciones genéticas o por otras moléculas de señalización oncogénicas, lo que permite a las células cancerosas migrar y ser más invasivas.[6] Otras CAM, como las selectinas y las integrinas, pueden facilitar la metástasis al mediar en las interacciones célula-célula entre las células tumorales metastásicas que migran en el sistema circulatorio y las células endoteliales de otros tejidos distantes.[36] Debido a la relación entre las CAM y la metástasis del cáncer, estas moléculas podrían ser posibles dianas terapéuticas para el tratamiento del cáncer.
También existen otras enfermedades genéticas humanas causadas por la incapacidad de expresar moléculas de adhesión específicas. Un ejemplo es la deficiencia de adhesión leucocitaria-I (LAD-I), en la que se reduce o se pierde la expresión de la subunidad β2 de la integrina.[37] Esto reduce la expresión de los heterodímeros de integrina β2, necesarios para que los leucocitos se adhieran firmemente a la pared endotelial en los focos de inflamación para combatir las infecciones.[38] Los leucocitos de pacientes con LAD-I son incapaces de adherirse a las células endoteliales y los pacientes presentan graves episodios de infección que pueden poner en peligro su vida.
Una enfermedad autoinmune llamada pénfigo también está causada por la pérdida de adhesión celular, ya que es el resultado de autoanticuerpos dirigidos contra las propias cadherinas desmosómicas de la persona, lo que provoca que las células epidérmicas se desprendan unas de otras y cause ampollas en la piel.[39]
Los microorganismos patógenos, como bacterias, virus y protozoos, tienen que adherirse primero a las células del huésped para infectar y causar enfermedades. La terapia antiadhesión puede utilizarse para prevenir la infección dirigiéndose a las moléculas de adhesión, ya sea en el patógeno o en la célula huésped.[40] Además de alterar la producción de moléculas de adhesión, también pueden utilizarse inhibidores competitivos que se unen a las moléculas de adhesión para impedir la unión entre células, actuando como agentes antiadhesión.[41]
Véase también
[editar]Referencias
[editar]- ↑ a b c d e f Lodish, Harvey; Berk, Arnold; Matsudaira, Paul; Kaiser, Chris A.; Krieger, Monty; Scott, Matthew P.; Zipursky, Lawrence; Darnell, James (2003). Molecular Cell Biology (5th edición). W.H. Freeman. ISBN 978-0716743668.
- ↑ a b c d e f g h Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Morgan, David; Raff, Martin; Roberts, Keith; Walter, Peter (2014). Molecular Biology of the Cell. (6th edición). Garland Science. ISBN 9780815344322.
- ↑ Gumbiner, Barry M. (1996). «Cell Adhesion: The Molecular Basis of Tissue Architecture and Morphogenesis». Cell 84 (3): 345-357. PMID 8608588. S2CID 13443584. doi:10.1016/S0092-8674(00)81279-9.
- ↑ Sumigray, Kaelyn D.; Lechler, Terry (2015). «Cell Adhesion in Epidermal Development and Barrier Formation». Current Topics in Developmental Biology 112. pp. 383-414. ISBN 9780124077584. PMC 4737682. PMID 25733147. doi:10.1016/bs.ctdb.2014.11.027.
- ↑ a b Okegawa, T; Pong, RC; Li, Y; Hsieh, JT (2004). «The role of cell adhesion molecule in cancer progression and its application in cancer therapy.». Acta Biochimica Polonica 51 (2): 445-57. PMID 15218541. doi:10.18388/abp.2004_3583.
- ↑ a b Hirohashi, Setsuo; Kanai, Yae (2003). «Cell adhesion system and human cancer morphogenesis». Cancer Science 94 (7): 575-581. PMID 12841864. S2CID 22154824. doi:10.1111/j.1349-7006.2003.tb01485.x.
- ↑ Szekanecz, Zoltan; Koch, Alisa E (2000). «Cell–cell interactions in synovitis: Endothelial cells and immune cell migration». Arthritis Research 2 (5): 368-373. PMC 130138. PMID 11094450. doi:10.1186/ar114.
- ↑ a b Pizarro-Cerdá, Javier; Cossart, Pascale (2006). «Bacterial Adhesion and Entry into Host Cells». Cell 124 (4): 715-727. PMID 16497583. S2CID 5769387. doi:10.1016/j.cell.2006.02.012.
- ↑ a b Mateo, M.; Generous, A.; Sinn, P. L.; Cattaneo, R. (2015). «Connections matter - how viruses use cellcell adhesion components». Journal of Cell Science 128 (3): 431-439. PMC 4311127. PMID 26046138. doi:10.1242/jcs.159400.
- ↑ Meng, W.; Takeichi, M. (2009). «Adherens Junction: Molecular Architecture and Regulation». Cold Spring Harbor Perspectives in Biology 1 (6): a002899. PMC 2882120. PMID 20457565. doi:10.1101/cshperspect.a002899.
- ↑ Nicholl ID, Matsui T, Weiss TM, Stanley CB, Heller WT, Martel A, Farago B, Callaway DJ, Bu Z (Aug 21, 2018). «Alpha-catenin structure and nanoscale dynamics in solution and in complex with F-actin». Biophysical Journal 115 (4): 642-654. Bibcode:2018BpJ...115..642N. PMC 6104293. PMID 30037495. doi:10.1016/j.bpj.2018.07.005.
- ↑ Harris, Tony J. C.; Tepass, Ulrich (2010). «Adherens junctions: from molecules to morphogenesis». Nature Reviews Molecular Cell Biology 11 (7): 502-514. PMID 20571587. S2CID 13638902. doi:10.1038/nrm2927.
- ↑ a b Johnson, J. L.; Najor, N. A.; Green, K. J. (2014). «Desmosomes: Regulators of Cellular Signaling and Adhesion in Epidermal Health and Disease». Cold Spring Harbor Perspectives in Medicine 4 (11): a015297. PMC 4208714. PMID 25368015. doi:10.1101/cshperspect.a015297.
- ↑ Delva, E.; Tucker, D. K.; Kowalczyk, A. P. (2009). «The Desmosome». Cold Spring Harbor Perspectives in Biology 1 (2): a002543. PMC 2742091. PMID 20066089. doi:10.1101/cshperspect.a002543.
- ↑ a b Steed, Emily; Balda, Maria S.; Matter, Karl (2010). «Dynamics and functions of tight junctions». Trends in Cell Biology 20 (3): 142-149. PMID 20061152. doi:10.1016/j.tcb.2009.12.002.
- ↑ Niessen, Carien M. (2007). «Tight Junctions/Adherens Junctions: Basic Structure and Function». Journal of Investigative Dermatology 127 (11): 2525-2532. PMID 17934504. doi:10.1038/sj.jid.5700865.
- ↑ a b Goodenough, D. A.; Paul, D. L. (2009). «Gap Junctions». Cold Spring Harbor Perspectives in Biology 1 (1): a002576. PMC 2742079. PMID 20066080. doi:10.1101/cshperspect.a002576.
- ↑ Meşe, Gülistan; Richard, Gabriele; White, Thomas W. (2007). «Gap Junctions: Basic Structure and Function». Journal of Investigative Dermatology 127 (11): 2516-2524. PMID 17934503. doi:10.1038/sj.jid.5700770.
- ↑ McEver, Rodger P. (2015). «Selectins: initiators of leucocyte adhesion and signalling at the vascular wall». Cardiovascular Research 107 (3): 331-339. PMC 4592324. PMID 25994174. doi:10.1093/cvr/cvv154.
- ↑ a b Barthel, Steven R; Gavino, Jacyln D; Descheny, Leyla; Dimitroff, Charles J (2007). «Targeting selectins and selectin ligands in inflammation and cancer». Expert Opinion on Therapeutic Targets 11 (11): 1473-1491. PMC 2559865. PMID 18028011. doi:10.1517/14728222.11.11.1473.
- ↑ Wong, Chee Wai; Dye, Danielle E.; Coombe, Deirdre R. (2012). «The Role of Immunoglobulin Superfamily Cell Adhesion Molecules in Cancer Metastasis». International Journal of Cell Biology 2012: 340296. PMC 3261479. PMID 22272201. doi:10.1155/2012/340296.
- ↑ a b Aricescu, A Radu; Jones, E Yvonne (2007). «Immunoglobulin superfamily cell adhesion molecules: zippers and signals». Current Opinion in Cell Biology 19 (5): 543-550. PMID 17935964. doi:10.1016/j.ceb.2007.09.010.
- ↑ a b Takada, Yoshikazu; Ye, Xiaojing; Simon, Scott (2007). «The integrins». Genome Biology 8 (5): 215. PMC 1929136. PMID 17543136. doi:10.1186/gb-2007-8-5-215.
- ↑ a b Lodish, Harvey; Berk, Arnold; Zipursky, S Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). Molecular cell biology (4th edición). W.H. Freeman. ISBN 978-0-7167-3136-8.
- ↑ Borradori, Luca; Sonnenberg, Arnoud (1999). «Structure and Function of Hemidesmosomes: More Than Simple Adhesion Complexes». Journal of Investigative Dermatology 112 (4): 411-418. PMID 10201522. doi:10.1046/j.1523-1747.1999.00546.x.
- ↑ a b Critchley, David R (2000). «Focal adhesions – the cytoskeletal connection». Current Opinion in Cell Biology 12 (1): 133-139. PMID 10679361. doi:10.1016/S0955-0674(99)00067-8.
- ↑ a b Cilia, Michelle Lynn; Jackson, David (2004). «Plasmodesmata form and function». Current Opinion in Cell Biology 16 (5): 500-506. PMID 15363799. doi:10.1016/j.ceb.2004.08.002.
- ↑ Singh, Ram Sarup; Walia, Amandeep Kaur; Kanwar, Jagat Rakesh (2016). «Protozoa lectins and their role in host–pathogen interactions». Biotechnology Advances 34 (5): 1018-1029. PMID 27268207. doi:10.1016/j.biotechadv.2016.06.002.
- ↑ Kadekoppala, Madhusudan; Holder, Anthony A. (2010). «Merozoite surface proteins of the malaria parasite: The MSP1 complex and the MSP7 family». International Journal for Parasitology 40 (10): 1155-1161. PMID 20451527. doi:10.1016/j.ijpara.2010.04.008.
- ↑ Kadekoppala, Madhusudan; Holder, Anthony A. (2010). «Merozoite surface proteins of the malaria parasite: The MSP1 complex and the MSP7 family». International Journal for Parasitology 40 (10): 1155-1161. PMID 20451527. doi:10.1016/j.ijpara.2010.04.008.
- ↑ Tronchin, Guy; Pihet, Marc; Lopes-Bezerra, Leila M.; Bouchara, Jean-Philippe (2008). «Adherence mechanisms in human pathogenic fungi». Medical Mycology 46 (8): 749-772. PMID 18651303. doi:10.1080/13693780802206435.
- ↑ Lima, O. C.; Figueiredo, C. C.; Previato, J. O.; Mendonca-Previato, L.; Morandi, V.; Lopes Bezerra, L. M. (2001). «Involvement of Fungal Cell Wall Components in Adhesion of Sporothrix schenckii to Human Fibronectin». Infection and Immunity 69 (11): 6874-6880. PMC 100066. PMID 11598061. doi:10.1128/IAI.69.11.6874-6880.2001.
- ↑ Klemm, Per; Schembri, Mark A. (2000). «Bacterial adhesins: function and structure». International Journal of Medical Microbiology 290 (1): 27-35. PMID 11043979. doi:10.1016/S1438-4221(00)80102-2.
- ↑ Garman, E. F. (2015). «Antiviral adhesion molecular mechanisms for influenza: W. G. Laver's lifetime obsession». Philosophical Transactions of the Royal Society B: Biological Sciences 370 (1661): 20140034. PMC 4275904. PMID 25533092. doi:10.1098/rstb.2014.0034.
- ↑ Capon, D J; Ward, R H R (1991). «The CD4-gpl20 Interaction and Aids Pathogenesis». Annual Review of Immunology 9 (1): 649-678. PMID 1910691. doi:10.1146/annurev.iy.09.040191.003245.
- ↑ Bendas, Gerd; Borsig, Lubor (2012). «Cancer Cell Adhesion and Metastasis: Selectins, Integrins, and the Inhibitory Potential of Heparins». International Journal of Cell Biology 2012: 676731. PMC 3296185. PMID 22505933. doi:10.1155/2012/676731.
- ↑ Harris, Estelle S.; Weyrich, Andrew S.; Zimmerman, Guy A. (2012). «Lessons from rare maladies: leukocyte adhesion deficiency syndromes». Current Opinion in Hematology 20 (1): 16-25. PMC 3564641. PMID 23207660. doi:10.1097/MOH.0b013e32835a0091.
- ↑ Hanna, Suhair; Etzioni, Amos (2012). «Leukocyte adhesion deficiencies». Annals of the New York Academy of Sciences 1250 (1): 50-55. Bibcode:2012NYASA1250...50H. PMID 22276660. S2CID 33727687. doi:10.1111/j.1749-6632.2011.06389.x.
- ↑ Tamgadge, Sandhya; Bhatt, DaivatM; Pereira, Treville; Tamgadge, Avinash; Bhalerao, Sudhir (2011). «Pemphigus vulgaris». Contemporary Clinical Dentistry 2 (2): 134-7. PMC 3180831. PMID 21957393. doi:10.4103/0976-237X.83074.
- ↑ Krachler, Anne Marie; Orth, Kim (2014). «Targeting the bacteria–host interface». Virulence 4 (4): 284-294. PMC 3710331. PMID 23799663. doi:10.4161/viru.24606.
- ↑ Ofek, Itzhak; Hasty, David L; Sharon, Nathan (2003). «Anti-adhesion therapy of bacterial diseases: prospects and problems». FEMS Immunology & Medical Microbiology 38 (3): 181-191. PMID 14522453. doi:10.1016/S0928-8244(03)00228-1.
Enlaces externos
[editar]- Esta obra contiene una traducción parcial derivada de «Cell adhesion» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
