Reacción de acoplamiento cruzado
Una reacción de acoplamiento cruzado en química orgánica es una reacción en la que dos fragmentos se unen con la ayuda de un catalizador metálico. En un tipo de reacción importante, un compuesto organometálico del grupo principal del tipo R-M (R = fragmento orgánico, M = centro del grupo principal) reacciona con un haluro orgánico del tipo R'-X con la formación de un nuevo enlace carbono-carbono en el producto R-R'.[1][2][3] Las reacciones de acoplamiento cruzado son un subconjunto de las reacciones de acoplamiento. A menudo se usa en arilaciones.
Historia[editar]
Hasta la década de 1960, solo se conocían reacciones de acoplamiento del tipo Wurtz-Fittig. En este caso, se hace reaccionar un compuesto organometálico con un haluro para formar el producto de acoplamiento y la eliminación del haluro metálico correspondiente. Aquí, los compuestos organometálicos de litio y magnesio son de particular importancia. Las reacciones no suelen estar catalizadas, sino que son reacciones estequiométricas. Sin embargo, estos antiguos acoplamientos no catalizados se limitan a unos pocos sustratos, como los haluros de alquilo, alilo y bencilo. La implementación con por ejemplo, vinilo o fenilo-haluros no es posible de esta manera, y los rendimientos de este tipo de acoplamiento son a menudo bastante modestos. Como resultado, este tipo de acoplamiento cruzado ha ganado poca importancia.
El prototipo del acoplamiento cruzado moderno se descubrió por primera vez en 1963 con el acoplamiento de Castro-Stephens. En este acoplamiento no catalizado, un acetiluro de cobre se convierte por acoplamiento en aril-acetileno.
En 1972, Kumada descubrió la reacción de acoplamiento que lleva su nombre.[4][5] En esta reacción catalizada por complejos de fosfina de níquel o fosfina de paladio, los compuestos de Grignard se acoplan con haluros de alquenilo o arilo en el sentido de un acoplamiento de Wurtz-Fittig. Sin embargo, en el sentido actual, esto no es un acoplamiento cruzado, ya que el acoplamiento dirigido de dos compañeros de reacción diferentes todavía era difícil de controlar.
Más tarde, en 1977, Ei-ichi Negishi publicó el primer acoplamiento cruzado real con la reacción que lleva su nombre.[6] En este acoplamiento entre un haluro de arilo y un organozinc, se preparan compuestos de biarilo asimétricos bajo catálisis de níquel o paladio. Esto sentó las bases para los acoplamientos cruzados actuales. Siguieron otros tipos de acoplamiento cruzado, todos los cuales siguen siendo relevantes hoy en día y han hecho que las reacciones de acoplamiento clásicas prácticamente no tengan sentido.
Richard Heck, Eiichi Negishi y Akira Suzuki recibieron el Premio Nobel de Química en 2010 por desarrollar reacciones de acoplamiento cruzado catalizadas por paladio.[7][8]
Acoplamiento cruzado carbono-carbono[editar]
Muchos acoplamientos cruzados implican la formación de enlaces carbono-carbono:
| Reacción | Año | Reactivo A | Reactivo B | Catalizador | Observaciones | ||
|---|---|---|---|---|---|---|---|
| Acoplamiento de Cadiot-Chodkiewicz | 1957 | RC≡CH | sp | RC≡CX | sp | Cu | Requiere base |
| Acoplamiento de Castro-Stephens | 1963 | RC≡CH | sp | Ar-X | sp2 | Cu | |
| Síntesis de Corey-House | 1967 | R2CuLi o RMgX | sp3 | R-X | sp2, sp3 | Cu | Versión catalizada por Cu de Kochi, 1971 |
| Acoplamiento de Kumada | 1972 | Ar-MgBr | sp2, sp3 | Ar-X | sp2 | Pd o Ni o Fe | |
| Reacción de Heck | 1972 | alkene | sp2 | Ar-X | sp2 | Pd o Ni | requiere base |
| Reacción de Sonogashira | 1975 | RC≡CH | sp | R-X | sp3 sp2 | Pd y Cu | requiere base |
| Acoplamiento de Negishi | 1977 | R-Zn-X | sp3, sp2, sp | R-X | sp3 sp2 | Pd o Ni | |
| Reacción de Stille | 1978 | R-SnR3 | sp3, sp2, sp | R-X | sp3 sp2 | Pd o Ni | |
| Reacción de Suzuki | 1979 | R-B(OR)2 | sp2 | R-X | sp3 sp2 | Pd o Ni | requiere base |
| Acoplamiento de Murahashi[9] | 1979 | R-Li | sp2, sp3 | R-X | sp2 | Pd o Ru | |
| Acoplamiento de Hiyama | 1988 | R-SiR3 | sp2 | R-X | sp3 sp2 | Pd | requiere base |
| Acoplamiento de Fukuyama | 1998 | R-Zn-I | sp3 | RCO(SEt) | sp2 | Pd o Ni | da cetonas |
| Acoplamiento de Liebeskind–Srogl | 2000 | R-B(OR)2 | sp3, sp2 | RCO(SEt) Ar-SMe | sp2 | Pd | requiere tiofeno-2-carboxilato de cobre (I) (CuTC), da cetonas |
| Acoplamiento deshidrogenativo cruzado(CDC) | 2004 | R-H | sp, sp2, sp3 | R'-H | sp, sp2, sp3 | Cu, Fe, Pd etc | requiere oxidante o deshidrogenación |
La preponderancia del uso de paladio en las catálisis homogéneas de las reacciones de acoplamiento cruzado C-C se basa en su capacidad para promover todas las reacciones elementales mecanísticamente esenciales (disociación del ligando, adición oxidante, inserción, eliminación reductora, beta-eliminación) junto con propiedades favorables como:
- Tolerancia a numerosos grupos funcionales.
- Relativa baja sensibilidad de los organocompuestos de paladio al aire y agua.
- Baja toxicidad.
- Más económico que sus reacciones homólogas con rodio, iridio y platino.[10]
Acoplamiento cruzado carbono-heteroátomo[editar]
Muchos acoplamientos cruzados implican la formación de enlaces carbono-heteroátomo (heteroátomo = S, N, O). Un método popular es la reacción de Buchwald-Hartwig:
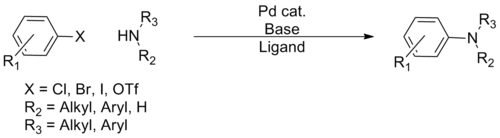 |
|
(Eq.1) |
| Reacción | Año | Reactivo A | Reactivo B | Catalizador | Observaciones | ||
|---|---|---|---|---|---|---|---|
| Ullmann condensación | ArO-MM, ArNH2,RS-M,NC-M | sp3 | Ar-X (X = OAr, N(H)Ar, SR, CN) | sp2 | Cu | ||
| Acoplamiento de Chan-Lam[11] | Ar-B(OR)2 | sp2 | Ar-NH2 | sp2 | Cu | ||
| Aminación de Buchwald-Hartwig[12] | 1994 | R2N-H | sp3 | R-X | sp2 | Pd | acoplamiento N-C, amina libre de segunda generación |
Referencias[editar]
- ↑ Organic Synthesis using Transition Metals Rod Bates ISBN 978-1-84127-107-1
- ↑ New Trends in Cross-Coupling: Theory and Applications Thomas Colacot (Editor) 2014 ISBN 978-1-84973-896-5
- ↑ King, A. O.; Yasuda, N. (2004). «Palladium-Catalyzed Cross-Coupling Reactions in the Synthesis of Pharmaceuticals». Organometallics in Process Chemistry. Topics in Organometallic Chemistry 6. Heidelberg: Springer. pp. 205-245. ISBN 978-3-540-01603-8. doi:10.1007/b94551.
- ↑ Corriu, R. J. P.; Masse, J. P. (1 de enero de 1972). «Activation of Grignard reagents by transition-metal complexes. A new and simple synthesis of trans-stilbenes and polyphenyls». Journal of the Chemical Society, Chemical Communications (3): 144a. doi:10.1039/C3972000144A.
- ↑ Tamao, Kohei; Sumitani, Koji; Kumada, Makoto (1 de junio de 1972). «Selective carbon–carbon bond formation by cross-coupling of Grignard reagents with organic halides. Catalysis by nickel-phosphine complexes». Journal of the American Chemical Society 94 (12): 4374-4376. doi:10.1021/ja00767a075.
- ↑ Negishi, E.; Takahashi, T. (April 1987). «Palladium- or Nickel-Catalyzed Reactions of Alkenylmetals with Unsaturated Organic Halides as a Selective Route to Arylated Alkenes and Conjugated Dienes: Scope, Limitations, and Mechanism». Journal of the Chemical Society: 2393.
- ↑ «The Nobel Prize in Chemistry 2010 - Richard F. Heck, Ei-ichi Negishi, Akira Suzuki». NobelPrize.org. 6 de octubre de 2010. Consultado el 6 de octubre de 2010.
- ↑ Johansson Seechurn, Carin C. C.; Kitching, Matthew O.; Colacot, Thomas J.; Snieckus, Victor (2012). «Palladium-Catalyzed Cross-Coupling: A Historical Contextual Perspective to the 2010 Nobel Prize». Angewandte Chemie International Edition 51 (21): 5062-5085. PMID 22573393. S2CID 20582425. doi:10.1002/anie.201107017.
- ↑ Murahashi, Shunichi; Yamamura, Masaaki; Yanagisawa, Kenichi; Mita, Nobuaki; Kondo, Kaoru (1979). «Stereoselective synthesis of alkenes and alkenyl sulfides from alkenyl halides using palladium and ruthenium catalysts». The Journal of Organic Chemistry (en inglés) 44 (14): 2408-2417. ISSN 0022-3263. doi:10.1021/jo01328a016.
- ↑ Elschenbroich, Christoph (2005). Organometallics. Willey-VCH. ISBN 978-3-527-29390-2.
- ↑ Jennifer X. Qiao; Patrick Y.S. Lam (2011). «Recent Advances in Chan–Lam Coupling Reaction: Copper-Promoted C–Heteroatom Bond Cross-Coupling Reactions with Boronic Acids and Derivatives». En Dennis G. Hall, ed. Boronic Acids: Preparation and Applications in Organic Synthesis, Medicine and Materials. Wiley-VCH. pp. 315-361. ISBN 9783527639328. doi:10.1002/9783527639328.ch6.
- ↑ Ruiz-Castillo, P.; Buchwald, S. L. (2016). «Applications of Palladium-Catalyzed C–N Cross-Coupling Reactions». Chemical Reviews 116 (19): 12564-12649. PMC 5070552. PMID 27689804. doi:10.1021/acs.chemrev.6b00512.
