Potencia celular

La potencia (latín "potentĭa", ‘poder, facultad’) es la capacidad de una célula para diferenciarse en otros tipos celulares.[1][2] A mayor sea la cantidad de tipos en que puede diferenciarse, mayor es su potencia. También es descrita como el potencial de activación génica de una célula que en un continuo comienza con la totipotencia para designar aquella célula con la potencia máxima, seguida de pluripotencia, multipotencia, oligopotencia y finalmente unipotencia.
Totipotencia[editar]
Totipotencia es la habilidad de una célula para dividirse y producir todas las células diferentes en el organismo. Ejemplos de células totipotentes son las esporas y el cigoto.[3] En el espectro potencial, la totipotencia representa a la célula con la mayor capacidad de diferenciación. Toti viene del latín totus ‘totalmente’.
Una célula completamente diferenciada puede volver a su estado totipotente.[4] Esta desdiferenciación es compleja, no comprendida del todo y tema de investigación de vanguardia. Estudios en 2011 han mostrado que las células no pueden desdiferenciarse en una célula completamente totipotente, sino en una "variación compleja" de célula totipotente.[5]
Usemos el modelo de desarrollo humano para describir cómo surgen las células totipotentes.[6] El desarrollo embrionario empieza cuando un espermatozoide fecunda un ovocito secundario y la fusión crea una única célula totipotente, un cigoto.[7] En las primeras horas luego de la fecundación, el cigoto se divide mediante mitosis en células totipotentes idénticas, que luego pueden diferenciarse en cualquiera de las tres capas germinativas (endodermo, mesodermo o ectodermo), o en el trofoblasto que formará la placenta. Después de alcanzar las 16 células, las células totipotentes de la mórula se diferencian en células que se convertirán en la masa celular interna o su capa exterior, que formará el trofoblasto. Aproximadamente luego de cuatro días después de la fecundación y luego de varios ciclos de división celular, estas células comienzan a especializarse. La masa celular interna, que originará a las células madres embrionarias, se convierten en pluripotentes.
Una investigación en Caenorhabditis elegans sugiere que múltiples mecanismos, incluido la regulación postraduccional, desempeñan un papel en mantener la totipotencia en diferentes etapas de desarrollo en algunas especies.[8] Estudios con peces cebra y mamíferos sugieren una interacción más profunda entre el miARN y las proteínas de unión a ARN (RBP) en la determinación de las diferencias de desarrollo.[9] En septiembre de 2013, un equipo del Centro Nacional de Investigaciones Oncológicas (CNIO) de España fueron capaces de desdiferenciar por primera vez células adultas de ratón a células con características de células madres embrionarias, alcanzando en consecuencia la totipotencia.[10]
Pluripotencia[editar]
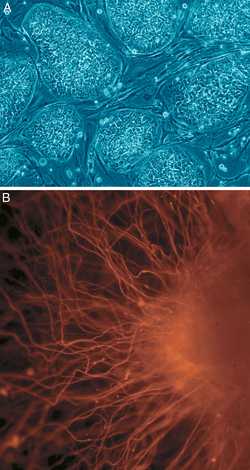
B. Neuronas.
La pluripotencia (del latín plurimus, ‘muchos’)[11] se refiere a una célula madre que tiene la potencia para diferenciarse en cualquiera de las capas germinativas: endodermo (revestimiento interior del estómago, tracto gastrointestinal, pulmones), mesodermo (músculo, hueso, sangre, aparato urogenital) o ectodermo (epidermis y sistema nervioso).[12] Sin embargo, la pluripotencia es un continuo, desde la célula totalmente pluripotente que puede formar cada célula del embrión propiamente dicho, esto es, células madres embrionarias y iPSC (véase más adelante), hasta la célula parcialmente pluripotente que puede formar células de todos las capas germinativas pero no puede exhibir todas las características de una célula completamente pluripotente.
Pluripotencia inducida[editar]
Las células madres pluripotentes inducidas (CMPI) son un tipo de células madres obtenidas artificialmente a partir de células no pluripotentes, típicamente una célula somática adulta, al inducir una expresión "forzada" de ciertos genes y factores de transcripción.[13] Estos factores de transcripción pueden desempeñar un papel clave en la determinación del estado de estas células y también subrayan el hecho de que las células somáticas contienen la misma información genética que el cigoto.[14] La técnica para inducir la pluripotencia fue utilizada con éxito en 2006 al usar fibroblastos de ratón y cuatro factores de transcripción (Oct4, Sox2, Klf4 y c-Myc),[15] proceso llamado reprogramación y que le valió el nobel de Fisiología o Medicina 2012 a Shinya Yamanaka junto a John Gurdon.[16] Luego le siguió la inducción de CMPI humanas a partir de fibroblastos dérmicos mediante un método similar al anterior.[17] Las CMPI poseen características similares a las células madres embionarias (CME) y no requieren el uso de un embrión. Las similitudes incluyen la pluripotencia, morfología, autoregeneración, lo que implica que puedan replicarse indefinidamente, y expresión génica.[18]
Se piensa que factores epigenéticos también están involucrados en la reprogramación de células somáticas para inducir la pluripotencia. En teoría, ciertos factores epigenéticos podrían de hecho limpiar las marcas epigenéticas originales de la célula somática con el propósito de adquirir nuevas marcas epigenéticas en el proceso de obtener la pluripotencia. Además la cromatina está reorganizada en las CMPI y se cambian de forma similar a lo encontrado en CME, en donde está menos condensada y por lo tanto más accesible para su expresión. Las modificaciones de la eucromatina son comunes, lo que es consistente con las CME.
Debido a su gran similitud a las CME, las CMPI han gozado de gran interés de la comunidad clínica y científica. Las CMPI hipotéticamente podrían tener las mismas implicaciones y aplicaciones terapéuticas que las CME, pero sin el controvertido uso de embriones en el proceso, un tema que genera un gran debate bioético. De hecho, la inducción a pluripotencia de células somáticas en células desdiferenciadas originalmente fue exclamado como el fin del conflicto. Sin embargo, se descubrió que las CMPI son potencialmente teratogénicas y, a pesar de los avances,[13] nunca se ha aprobado su uso para la etapa clínica de investigación en los Estados Unidos. Por si fuera poco, se encuentran contratiempos al proliferar CMPI debido a las bajas tasas de replicación y la senescencia temprana, lo que entorpece su uso como reemplazo de CME.
Adicionalmente, se ha determinado que la expresión somática de una combinación de factores de transcripción puede inducir directamente otros destinos celulares mediante transdiferenciación. Investigadores han identificado tres factores de transcripción específicos para el linaje neural que pueden convertir directamente fibroblastos de ratón en neuronas completamente funcionales.[19] Estos resultados contradicen la naturaleza terminal de la diferenciación celular y la integridad del compromiso a una línea histológica, e implica que mediante las herramientas apropiadas, todas las células son totipotentes y puedan formar todos los tipos de tejido.
Algunos de los posibles usos clínicos de las CMPI obtenidas de pacientes, incluyen el trasplante autológico de sus propias células y tejidos, lo que excluye el común riesgo de rechazo inmunológico. Las CMPI podrían potencialmente sustituir los modelos de animales y modelos in vitro para una investigación de enfermedades más adecuada.[20]
Multipotencia[editar]

La multipotencia describe a las células progenitoras que tienen el potencial de activación génica para diferenciarse en múltiples, pero limitados, tipos celulares. Por ejemplo, una célula hematopoyética es una célula sanguínea multipotente. Este tipo celular puede diferenciarse en cualquier tipo de célula sanguínea diferenciada como linfocitos, monocitos, neutrófilos, etc., pero no puede diferenciarse en neuronas, células hematopoyéticas u otros tipos distintos al sanguíneo.
Nuevos estudios relacionados con células multipotentes sugieren que las células multipotentes son capaces de convertirse en tipos celulares no relacionados. Por ejemplo, en un caso fibroblastos se convirtieron en neuronas funcionales.[19] En otro caso, células madres humanas de cordón umbilical pudieron convertirse en neuronas.[21]
Se encuentran células multipotentes en muchos tipos celulares, pero no en todos. Se han encontrado en tejido adiposo,[22] cardíaco,[23] médula ósea y en células mesenquimátosas de estroma (MCS) que se hallan en los terceros molares.[24]
Las MCS han probado ser fuente buena y confiable para células madres debido a la facilidad de su recolección de molares de 8-10 años, anterior a la calcificación dental adulta. Las MCS pueden diferenciarse en osteoblastos, condrocitos y adipocitos.[25]
Oligopotencia[editar]
La oligopotencia es la habilidad de las células progenitores para diferenciarse en unos pocos tipos celulares. Ejemplos de células oligopotentes son las células madres linfoides y mieloides.[1] En concreto, una célula linfoide puede dar origen a varias células sanguíneas como los linfocitos T y B, sin embargo, no puede diferenciarse en células de otro linaje sanguíneo como un eritrocito.[26] Ejemplos de células progenitoras que son las células madres vasculares que tienen la capacidad de convertirse tanto en células endoteliales como musculares lisas.
Unipotencia[editar]
La unipotencia es el concepto de que una célula madre tiene la capacidad de diferenciarse únicamente en un tipo celular. Aún es incierto si realmente las células unipotentes existen. Hepatolastos, que pueden diferenciarse en hepatocito (que constituye la mayor parte del hígado) o colangiocitos (células epiteliales del conducto biliar), son ejemplos de células bipotentes.[27] Un término cercano para célula unipotente es célula precursora.
Referencias[editar]
- ↑ a b Hans R. Schöler (2007). «The Potential of Stem Cells: An Inventory». En Nikolaus Knoepffler, Dagmar Schipanski, and Stefan Lorenz Sorgner, ed. Human biotechnology as Social Challenge. Ashgate Publishing, Ltd. p. 28. ISBN 978-0-7546-5755-2.
- ↑ «Stem Cell School: Glossary». Archivado desde el original el 7 de octubre de 2016.
- ↑ Mitalipov S, Wolf D; Wolf (2009). «Totipotency, pluripotency and nuclear reprogramming». Advances in Biochemical Engineering & Biotechnology 114: 185-99. Bibcode:2009esc..book..185M. ISBN 978-3-540-88805-5. PMC 2752493. PMID 19343304. doi:10.1007/10_2008_45.
- ↑ Western P (2009). «Foetal germ cells: striking the balance between pluripotency and differentiation». Int. J. Dev. Biol. 53 (2–3): 393-409. PMID 19412894. doi:10.1387/ijdb.082671pw.
- ↑ Sugimoto K, Gordon SP, Meyerowitz EM (abril de 2011). «Regeneration in plants and animals: dedifferentiation, transdifferentiation, or just differentiation?». Trends Cell Biol. 21 (4): 212-8. PMID 21236679. doi:10.1016/j.tcb.2010.12.004.
- ↑ Seydoux G, Braun RE (diciembre de 2006). «Pathway to totipotency: lessons from germ cells». Cell 127 (5): 891-904. PMID 17129777. doi:10.1016/j.cell.2006.11.016.
- ↑ Asch R, Simerly C, Ord T, Ord VA, Schatten G (julio de 1995). «The stages at which human fertilization arrests: microtubule and chromosome configurations in inseminated oocytes which failed to complete fertilization and development in humans». Hum. Reprod. 10 (7): 1897-906. PMID 8583008.
- ↑ Ciosk, R.; Depalma, Michael; Priess, James R. (10 de febrero de 2006). «Translational Regulators Maintain Totipotency in the Caenorhabditis elegans Germline». Science 311 (5762): 851-853. Bibcode:2006Sci...311..851C. PMID 16469927. doi:10.1126/science.1122491.
- ↑ Kedde M, Agami R (abril de 2008). «Interplay between microRNAs and RNA-binding proteins determines developmental processes». Cell Cycle 7 (7): 899-903. PMID 18414021.
- ↑ Serrano, Manuel (11 de septiembre de 2013). «Study published in Nature is another step towards regenerative medicine». cnio.es. Archivado desde el original el 14 de diciembre de 2013. Consultado el 11 de diciembre de 2013.
- ↑ «Biology Online». Biology-Online.org. Consultado el 25 de abril de 2013.
- ↑ Binder, edited by Marc D.; Hirokawa, Nobutaka; (eds.), Uwe Windhorst (2009). Encyclopedia of neuroscience ([Online-Ausg.] edición). Berlin: Springer. ISBN 978-3540237358.
- ↑ a b Baker, Monya (6 de diciembre de 2007). «Adult cells reprogrammed to pluripotency, without tumors». Nature Reports Stem Cells. doi:10.1038/stemcells.2007.124.
- ↑ Stadtfeld, M.; Hochedlinger, K. (15 de octubre de 2010). «Induced pluripotency: history, mechanisms, and applications». Genes & Development 24 (20): 2239-2263. doi:10.1101/gad.1963910.
- ↑ Takahashi, Kazutoshi; Yamanaka, Shinya (agosto de 2006). «Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors». Cell 126 (4): 663-676. PMID 16904174. doi:10.1016/j.cell.2006.07.024.
- ↑ "The Nobel Prize in Physiology or Medicine 2012". Nobelprize.org. Nobel Media AB 2013. Web. 28 Nov 2013.
- ↑ Takahashi, Kazutoshi; Tanabe, Koji; Ohnuki, Mari; Narita, Megumi; Ichisaka, Tomoko; Tomoda, Kiichiro; Yamanaka, Shinya (1 de noviembre de 2007). «Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors». Cell 131 (5): 861-872. PMID 18035408. doi:10.1016/j.cell.2007.11.019.
- ↑ Liang, Gaoyang; Zhang, Yi (18 de diciembre de 2012). «Embryonic stem cell and induced pluripotent stem cell: an epigenetic perspective». Cell Research 23 (1): 49-69. PMC 3541668. PMID 23247625. doi:10.1038/cr.2012.175.
- ↑ a b Vierbuchen T, Wernig M et al. (febrero de 2010). «Direct conversion of fibroblasts to functional neurons by defined factors». Nature 463 (7284): 1035-41. Bibcode:2010Natur.463.1035V. PMC 2829121. PMID 20107439. doi:10.1038/nature08797.
- ↑ Park, IH; Lerou, PH; Zhao, R; Huo, H; Daley, GQ (2008). «Generation of human-induced pluripotent stem cells.». Nature protocols 3 (7): 1180-6. PMID 18600223. doi:10.1038/nprot.2008.92.
- ↑ Giorgetti A, Marchetto MC, Li M et al. (julio de 2012). «Cord blood-derived neuronal cells by ectopic expression of Sox2 and c-Myc». Proc. Natl. Acad. Sci. U.S.A. 109 (31): 12556-61. Bibcode:2012PNAS..10912556G. PMC 3412010. PMID 22814375. doi:10.1073/pnas.1209523109.
- ↑ Tallone T, Realini C, Böhmler A et al. (abril de 2011). «Adult human adipose tissue contains several types of multipotent cells». J Cardiovasc Transl Res 4 (2): 200-10. PMID 21327755. doi:10.1007/s12265-011-9257-3.
- ↑ Beltrami AP, Barlucchi L, Torella D et al. (septiembre de 2003). «Adult cardiac stem cells are multipotent and support myocardial regeneration». Cell 114 (6): 763-76. PMID 14505575. doi:10.1016/S0092-8674(03)00687-1.
- ↑ Ohgushi H, Arima N, Taketani T (diciembre de 2011). «[Regenerative therapy using allogeneic mesenchymal stem cells]». Nippon Rinsho (en japonés) 69 (12): 2121-7. PMID 22242308.
- ↑ Uccelli, Antonio; Moretta, Pistoia (septiembre de 2008). «Mesenchymal stem cells in health and disease». Nature Reviews 8 (9): 726. PMID 19172693. doi:10.1038/nri2395.
- ↑ Ibelgaufts, Horst. «Cytokines & Cells Online Pathfinder Encyclopedia». Consultado el 25 de abril de 2013.
- ↑ «hepatoblast differentiation». GONUTS. Archivado desde el original el 3 de marzo de 2016. Consultado el 4 de abril de 2014.
