Isoquinoleína
| Isoquinolina | ||
|---|---|---|
 | ||
| General | ||
| Otros nombres | 2-Azanaftaleno. Benzo[c]piridina. 2-Benzanina. | |
| Fórmula estructural |
 | |
| Fórmula molecular | C9H7N | |
| Identificadores | ||
| Número CAS | 119-65-3[1] | |
| ChEBI | 16092 | |
| ChEMBL | CHEMBL12315 | |
| ChemSpider | 8098 | |
| DrugBank | 04329 | |
| PubChem | 8405 | |
| UNII | JGX76Y85M6 | |
| KEGG | C06323 | |
| Propiedades físicas | ||
| Apariencia | Líquido oleoso amarillento, escamas higroscópicas cuando se encuentra sólido. Olor desagradable. | |
| Densidad | 1,099 kg/m³; 0,001099 g/cm³ | |
| Masa molar | 129,16 g/mol | |
| Punto de fusión | 27 °C (300 K) | |
| Punto de ebullición | 242 °C (515 K) | |
| Propiedades químicas | ||
| Acidez | pKBH+=5.14[2] pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La isoquinoleína (también isoquinolina) es un compuesto orgánico heterocíclico. Es un isómero estructural de la quinoleína. La isoquinoleína y la quinoleína son benzopiridinas, las cuales se componen de un anillo de piridina fusionado con un anillo de benceno.
Síntesis[editar]
Existen diversos métodos para sintetizar quinolinas e hidroquinolinas.:



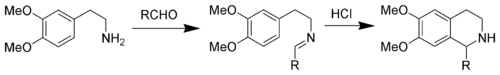

Isoquinolinas naturales[editar]
La 1-Bencilisoquinolina es el esqueleto base de los alcaloides tetrahidroisoquinolínicos, como por ejemplo la papaverina.[3][4][5][6][7][8]
Producción[editar]
La Isoquinolina fue primero aislada del alquitrán de hulla en 1885 por Hoogewerf y van Dorp.[9] Ellos lo aislaron por cristalización fraccionada del sulfato ácido. Weissgerber desarrolló una ruta más rápida en 1914 por extracción selectiva del alquitrán de hulla, aprovechando el hecho de que la isoquinolina es más básica que la quinolina.
Referencias[editar]
- ↑ Número CAS
- ↑ Brown, H.C., et al., in Baude, E.A. and Nachod, F.C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- ↑ Gilchrist, T.L. (1997). Heterocyclic Chemistry (3rd ed.). Essex, UK: Addison Wesley Longman.
- ↑ Harris, J.; Pope, W.J. "isoQuinoline and the isoQuinoline-Reds" Journal of the Chemical Society (1922) volume 121, pp. 1029-1033.
- ↑ Katritsky, A.R.; Pozharskii, A.F. (2000). Handbook of Heterocyclic Chemistry (2nd ed.). Oxford, UK: Elsevier.
- ↑ Katritsky, A.R.; Rees, C.W.; Scriven, E.F. (Eds.). (1996). Comprehensive Heterocyclic Chemistry II: A Review of the Literature 1982-1995 (Vol. 5). Tarrytown, NY: Elsevier.
- ↑ Nagatsu, T. "Isoquinoline neurotoxins in the brain and Parkinson's disease" Neuroscience Research (1997) volume 29, pp. 99-111.
- ↑ O'Neil, Maryadele J. (Ed.). (2001). The Merck Index (13th ed.). Whitehouse Station, NJ: Merck.
- ↑ S. Hoogewerf and W.A. van Dorp (1885) "Sur un isomére de la quinoléine" (On an isomer of quinoline), Recueil des Travaux Chemiques des Pays-Bas (Collection of Work in Chemistry in the Netherlands), vol.4, no. 4, pages 125-129. See also: S. Hoogewerf and W.A. van Dorp (1886) "Sur quelques dérivés de l'isoquinoléine" (On some derivatives of isoquinoline), Recueil des Travaux Chemiques des Pays-Bas, vol.5, no. 9, pages 305-312.
