Interacción antígeno-anticuerpo
La interacción antígeno-anticuerpo o reacción antígeno-anticuerpo, es una interacción química específica entre los anticuerpos producidos por las células B de los glóbulos blancos y los antígenos durante la reacción inmune. Es la reacción fundamental en el cuerpo mediante la cual el cuerpo está protegido de moléculas extrañas complejas, como los patógenos y sus toxinas químicas. En la sangre, los antígenos están específicamente y con alta afinidad unidos por los anticuerpos para formar un complejo antígeno-anticuerpo. El complejo inmune luego se transporta a los sistemas celulares donde se puede destruir o desactivar.
La primera descripción correcta de la reacción antígeno-anticuerpo fue dada por Richard J. Goldberg en la Universidad de Wisconsin en 1952.[1][2] Llegó a conocerse como la "teoría de Goldberg" (de la reacción antígeno-anticuerpo).[3]
Hay varios tipos de anticuerpos y antígenos, y cada anticuerpo es capaz de unirse solo a un antígeno específico. La especificidad de la unión se debe a la constitución química específica de cada anticuerpo. El determinante antigénico o epítopo es reconocido por el parátope del anticuerpo, situado en la región variable de la cadena polipeptídica. La región variable a su vez tiene regiones hipervariables que son secuencias de aminoácidos únicas en cada anticuerpo. Los antígenos se unen a los anticuerpos a través de interacciones débiles y no covalentes, tales como interacciones electrostáticas, enlaces de hidrógeno, fuerzas de Van der Waals e interacciones hidrófobas.[4]
Los principios de especificidad y reactividad cruzada de la interacción antígeno-anticuerpo son útiles en el laboratorio clínico para fines de diagnóstico. Una aplicación básica es la determinación del grupo sanguíneo ABO. También se usa como una técnica molecular para la infección con diferentes patógenos, como el VIH, los microbios y los parásitos helmintos.
Base molecular[editar]
La inmunidad desarrollada a medida que un individuo se expone a antígenos se denomina inmunidad adaptativa o adquirida, en contraste con la inmunidad desarrollada al nacer, que es la inmunidad innata. La inmunidad adquirida depende de la interacción entre los antígenos y un grupo de proteínas llamadas anticuerpos producidos por las células B de la sangre. Hay muchos anticuerpos y cada uno es específico para un tipo particular de antígeno. Por lo tanto, la respuesta inmune en la inmunidad adquirida se debe a la unión precisa de los antígenos al anticuerpo. Solo un área muy pequeña de los antígenos y las moléculas de anticuerpos realmente interactúan a través de los sitios de unión complementarios, llamados epítopos en antígenos y paratopes en anticuerpos.[5]
Estructura de anticuerpos[editar]
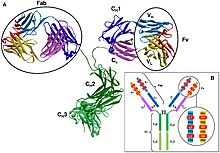
En un anticuerpo, la región Fab (fragmento, unión a antígeno) se forma a partir del extremo amino terminal de las cadenas ligeras y pesadas del polipéptido de inmunoglobulina. Esta región, llamada dominio variable (V), está compuesta por secuencias de aminoácidos que definen cada tipo de anticuerpo y su afinidad de unión a un antígeno. La secuencia combinada de cadena ligera variable (VL) y variable de cadena pesada (VH) crea tres regiones hipervariables (HV1, HV2 y HV3). En VL, estos son aproximadamente de los residuos 28 a 35, de 49 a 59, y de 92 a 103, respectivamente. HV3 es la parte más variable. Así, estas regiones son el paratopo, el sitio de unión de un antígeno. El resto de la región V entre las regiones hipervariables se denominan regiones marco. Cada dominio V tiene cuatro dominios marco, a saber, FR1, FR2, FR3 y FR4.[4][6]
Propiedades[editar]
Bases químicas de la interacción antígeno-anticuerpo[editar]
Los anticuerpos se unen a los antígenos a través de interacciones químicas débiles, y el enlace es esencialmente no covalente. Se sabe que las interacciones electrostáticas, los enlaces de hidrógeno, las fuerzas de van der Waals y las interacciones hidrófobas están involucradas, dependiendo de los sitios de interacción.[7][8] Los enlaces no covalentes entre el anticuerpo y el antígeno también pueden estar mediados por moléculas de agua interfacial. Tales enlaces indirectos pueden contribuir al fenómeno de la reactividad cruzada, es decir, el reconocimiento de antígenos diferentes pero relacionados por un solo anticuerpo.[9]
Afinidad de la interacción[editar]
El antígeno y el anticuerpo interactúan a través de una unión de alta afinidad, como el bloqueo y la llave[10] Existe un equilibrio dinámico para la unión. Por ejemplo, la reacción es reversible y se puede expresar como:
donde [Ab] es la concentración de anticuerpo y [Ag] es la concentración de antígeno, ya sea en estado libre ([Ab], [Ag]) o unido ([AbAg]).
La constante de asociación de equilibrio puede por lo tanto representarse como:
donde K es la constante de equilibrio.
Recíprocamente la constante de disociación será:
Sin embargo, estas ecuaciones son aplicables solo a la unión de un único epítopo, es decir, un antígeno en un anticuerpo. Dado que el anticuerpo necesariamente tiene dos paratopes, y en muchas circunstancias se produce una unión compleja, el equilibrio de unión múltiple se puede resumir como:
donde, en el equilibrio, c es la concentración de ligando libre, r representa la relación de la concentración de ligando unido a la concentración total de anticuerpo y n es el número máximo de sitios de unión por molécula de anticuerpo (la valencia del anticuerpo).
La fuerza global de la unión de un anticuerpo a un antígeno se denomina su avidez por ese antígeno. Dado que los anticuerpos son bivalentes o polivalentes, esta es la suma de las fortalezas de las interacciones anticuerpo-antígeno individuales. La fuerza de una interacción individual entre un único sitio de unión en un anticuerpo y su epítopo objetivo se denomina afinidad de esa interacción.
La avidez y la afinidad se pueden juzgar por la constante de disociación de las interacciones que describen. Cuanto más baja sea la constante de disociación, mayor será la avidez o afinidad y más fuerte será la interacción.
Enfermedad autoinmune[editar]
Normalmente, los anticuerpos pueden detectar y diferenciar moléculas del exterior del cuerpo y aquellas producidas dentro del cuerpo como resultado de actividades celulares. Moléculas propias como ignoradas por el sistema inmune. Sin embargo, en ciertas condiciones, los anticuerpos reconocen las moléculas propias como antígenos y desencadenan respuestas inmunes inesperadas. Esto resulta en diferentes enfermedades autoinmunes dependiendo del tipo de antígenos y anticuerpos involucrados. Tales condiciones son siempre dañinas y algunas veces mortales. Aún no se conoce la naturaleza exacta de la interacción anticuerpo-antígeno en la enfermedad autoinmune.[11][12]
Solicitud[editar]
La interacción antígeno-anticuerpo se utiliza en técnicas de laboratorio para pruebas serológicas de compatibilidad sanguínea y diversas infecciones patógenas. La más básica es la determinación de grupo sanguíneo ABO, que es útil para la transfusión de sangre.[13] Las aplicaciones sofisticadas incluyen ELISA,[14] immunospot enlazado a enzimas (Elispot), inmunofluorescencia e inmunoelectroforesis.[15][16][17]
Reacción de precipitación[editar]
Los antígenos solubles se combinan con anticuerpos solubles en presencia de un electrolito a una temperatura y pH adecuados para formar un complejo visible insoluble. Esto se llama una reacción de precipitación. Se utiliza para la determinación cualitativa y cuantitativa de antígeno y anticuerpo. Una prueba de anillo especial es útil para el diagnóstico de ántrax y la determinación de la adulteración en los alimentos.
Reacción de aglutinación[editar]
Actúa sobre la reacción antígeno-anticuerpo en la que los anticuerpos entrecruzan los antígenos particulados dando como resultado la aglomeración visible de la partícula. Hay dos tipos, a saber, aglutinación activa y pasiva. Se utilizan en los análisis de sangre para el diagnóstico de fiebre entérica.
Referencias[editar]
- ↑ Goldberg, Richard J. (1952). «A Theory of Antibody—Antigen Reactions. I. Theory for Reactions of Multivalent Antigen with Bivalent and Univalent Antibody». Journal of the American Chemical Society 74 (22): 5715-5725. doi:10.1021/ja01142a045.
- ↑ Sahimi, Muhammad (1994). Applications of Percolation Theory. London: CRC Press. p. 257. ISBN 978-0-203-22153-2.
- ↑ Spiers, JA (1958). «Goldberg's theory of antigen-antibody reactions in vitro». Immunology 1 (2): 89-102. PMC 1423897. PMID 13538526.
- ↑ a b Janeway, Charles A Jr; Travers, Paul; Walport, Mark; Shlomchik, Mark J (2001). Immunobiology: The Immune System in Health and Disease (5 edición). New York: Garland Science. ISBN 0-8153-3642-X.
- ↑ Sela-Culang, Inbal; Kunik, Vered; Ofran, Yanay (2013). «The structural basis of antibody-antigen recognition». Frontiers in Immunology 4: 302. PMC 3792396. PMID 24115948. doi:10.3389/fimmu.2013.00302.
- ↑ Mian, I.Saira; Bradwell, Arthur R.; Olson, Arthur J. (1991). «Structure, function and properties of antibody binding sites». Journal of Molecular Biology 217 (1): 133-151. PMID 1988675. doi:10.1016/0022-2836(91)90617-F.
- ↑ van Oss, CJ; Good, RJ; Chaudhury, MK (1986). «Nature of the antigen-antibody interaction. Primary and secondary bonds: optimal conditions for association and dissociation». Journal of Chromatography 376: 111-9. PMID 3711190.
- ↑ Absolom, DR; van Oss, CJ (1986). «The nature of the antigen-antibody bond and the factors affecting its association and dissociation». CRC Critical Reviews in Immunology 6 (1): 1-46. PMID 3522103.
- ↑ Lisova, O; Belkadi, L; Bedouelle, Hugues (Apr 2014). «Direct and indirect interactions in the recognition between a cross-neutralizing antibody and the four serotypes of dengue virus». J. Mol. Recognit. 27 (4): 205-214. PMID 24591178. doi:10.1002/jmr.2352.
- ↑ Braden, BC; Dall'Acqua, W; Eisenstein, E; Fields, BA; Goldbaum, FA; Malchiodi, EL; Mariuzza, RA; Schwarz, FP et al. (1995). «Protein motion and lock and key complementarity in antigen-antibody reactions.». Pharmaceutica acta Helvetiae 69 (4): 225-30. PMID 7651966. doi:10.1016/0031-6865(94)00046-x.
- ↑ Cornaby, Caleb; Gibbons, Lauren; Mayhew, Vera; Sloan, Chad S.; Welling, Andrew; Poole, Brian D. (2015). «B cell epitope spreading: Mechanisms and contribution to autoimmune diseases». Immunology Letters 163 (1): 56-68. PMID 25445494. doi:10.1016/j.imlet.2014.11.001.
- ↑ Imkeller, Katharina; Wardemann, Hedda (2018). «Assessing human B cell repertoire diversity and convergence». Immunological Reviews 284 (1): 51-66. PMID 29944762. doi:10.1111/imr.12670.
- ↑ Mayer, Gene. «Immunoglobulins- antigen-antibody reactions and selected tests». Microbiology and Immunology. University of South Carolina School of Medicine. Consultado el 10 de marzo de 2015.
- ↑ Margolis, Simeon (5 de enero de 2012). «Antigen/Antibody Tests for Infectious Disease». Remedy Health Media, LLC. Consultado el 10 de marzo de 2015.
- ↑ Taylor, Charles W.; Chakrabarty, Subhas; Schauder, Keith S.; Yeoman, Lynn C. (1983). «Identification of Cytosolic Antigens from GW-39 Adenocarcinoma Cells by Crossed Immunoelectrophoresis and Immunofluorescence». Immunological Investigations 12 (3): 315-329. doi:10.3109/08820138309050753.
- ↑ Ferenčík, Miroslav (2013). Handbook of Immunochemistry. Netherlands: Springer. pp. 309-386. ISBN 978-94-010-4678-7. doi:10.1007/978-94-011-1552-0_12.
- ↑ Odell, Ian D; Cook, Deborah (2013). «Immunofluorescence Techniques». Journal of Investigative Dermatology 133 (1): e4. doi:10.1038/jid.2012.455.

![{\displaystyle {\ce {[Ab] + [Ag] <=> [AbAg]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/811fa758653c8d49cd0ce39294d057605d41ea0c)
![{\displaystyle K_{a}={\frac {k_{{\ce {on}}}}{k_{{\ce {off}}}}}={\frac {{\ce {[AbAg]}}}{{\ce {[Ab][Ag]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b1a025e34905d807924817cf21ed4e800e2bd87)
![{\displaystyle K_{d}={\frac {k_{{\ce {off}}}}{k_{{\ce {on}}}}}={\frac {{\ce {[Ab][Ag]}}}{{\ce {[AbAg]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/06053e68e377c191d306c1b2e3e107b501c690eb)
![{\displaystyle K_{a}={\frac {k_{{\ce {on}}}}{k_{{\ce {off}}}}}={\frac {{\ce {[AbAg]}}}{{\ce {[Ab][Ag]}}}}={\frac {r}{c(n-r)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f9f4e8ebefef3ea5f8e78c76d74c29395c8f23c)