Ciclo sexual femenino

El ciclo menstrual o ciclo ovárico consiste en una serie de cambios regulares que de forma natural ocurren en el sistema reproductor femenino (especialmente en el útero y los ovarios) los cuales hacen posible el embarazo o la menstruación, en caso de que el primero no tenga lugar, durante este ciclo se desarrollan los ovocitos.
Alrededor del 80 % de las mujeres reportan síntomas desde una o dos semanas antes de la menstruación.
Primera menstruación[editar]
La primera menstruación ocurre entre los once y quince años y recibe el nombre de menarquía. La edad promedio de la menarquía es generalmente superior en los países desarrollados que en los países en vías de desarrollo. La misma aparece cuando todas las partes del aparato reproductor de la niña han madurado y funcionan en conjunto. Esto indica el comienzo de la capacidad reproductiva. Constituye el principal marcador psicológico de la transición de la infancia a la edad adulta.
Luego de la menopausia la menstruación deja de ocurrir por la pérdida de la estimulación hormonal, oscilando entre los 45 y 55 años. La pérdida de sangre normalmente dura alrededor de 2 a 7 días.
Fases del ciclo menstrual[editar]
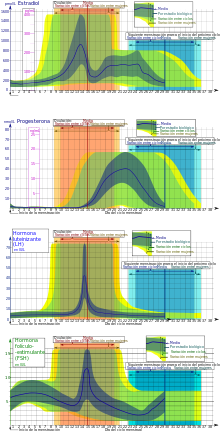
Menstruación[editar]
También llamada regla, periodo o sangrado menstrual, su inicio es el primer día del ciclo menstrual. Durante esta fase se desprende el endometrio junto a una cantidad de sangre. Este sangrado suele tomarse como señal de que una mujer no está embarazada (aunque existen algunas excepciones que pueden causar sangrados durante el embarazo; en el inicio del embarazo pueden producir un fuerte sangrado).[1][2][3]
La menstruación media suele durar unos días, normalmente entre tres y cinco, aunque se considera normal las que estén entre dos y siete días.[4][5] La pérdida de sangre suele ser de unos 35 ml, considerándose normal entre 10 y 80 ml.[6] Las mujeres que tienen menorragia tienen predisposición a sufrir anemia.[7] Una enzima llamada plasmina evita que el fluido menstrual se coagule.[8]
Durante los primeros días de la menstruación son comunes los dolores en el abdomen, la espalda o la parte superior de los muslos. El dolor uterino severo se conoce como dismenorrea y es más frecuente entre las adolescentes y mujeres jóvenes (afectando al 67,2 % de las adolescentes).[9] La dismenorrea puede explicarse como un proceso inflamatorio. Aunque aun se desconocen muchos aspectos, se sabe que el proceso es mediado por prostaglandinas y células polimorfonucleares. La progesterona tiene propiedades antiinflamatorias, al caer los niveles de progesterona se desencadena el proceso inflamatorio.[10] Cuando comienza la menstruación los síntomas del síndrome premenstrual, como irritabilidad o hinchazón y dolor de los pechos, decrecen.[5] Existen a la venta gran variedad de productos sanitarios para que las mujeres usen durante la menstruación (compresas, tampones y copas).
Preovulación[editar]
También llamada fase folicular o fase proliferativa ya que durante este periodo el endometrio crece y se engruesa por acción del estradiol.[11] Suele durar desde el primer hasta el decimotercer día del ciclo.
A través de la influencia de la hormona foliculoestimulante (FSH), que aumenta durante los primeros días del ciclo, se estimulan unos pocos folículos ováricos.[11] Estos folículos, presentes desde el nacimiento,[11] se van desarrollando en un proceso llamado foliculogénesis.
La foliculogénesis comprende la formación y maduración del folículo ovárico, una densa cáscara empaquetada de células somáticas que contiene un ovocito inmaduro y donde tiene lugar la meiosis. Eso describe la progresión de una serie de pequeños folículos primordiales en grandes folículos preovulatorios que ocurre en parte durante el ciclo menstrual. Dura 2 meses desde el principio hasta el final.
Posteriormente, todos los folículos dejan de crecer y entran en atresia; excepto uno. Este es el folículo dominante y continuará hasta su madurez, formando el folículo de Graaf, que contiene el ovocito que se libera en la ovulación.[11]
Aún no están esclarecidos los mecanismos biológicos por los cuales es seleccionado el folículo dominante. De forma aleatoria, al inicio del reclutamiento, unos folículos progresaran e iniciaran el proceso de forma más rápida que otros, lo que les va a otorgar cierta ventaja. Dentro de este grupo, habrá algunos que tengan una mayor cantidad de receptores para la FSH que otros, y además, dentro de estos, algunos de estos folículos tendrá receptores más eficientes que otros. Con lo cual, se irá dando un proceso de selección positiva de aquel folículo que inicie con mayor rapidez, tenga más receptores y de mejor calidad que hará que acapare más FSH, haciendo que los demás folículos frenen su crecimiento y finalmente se atresien.
A medida que van madurando, los folículos secretan cantidades crecientes de estradiol, un estrógeno. Los niveles de estradiol aumentan significativamente cuando se selecciona el folículo dominante, pues este secreta una enorme cantidad. Los estrógenos inician la formación de una nueva capa del endometrio en el útero (endometrio proliferativo). El estrógeno también estimula las criptas del cuello uterino para que produzca moco cervical fértil, el cual será identificado por las mujeres que comprueben sus días más fértiles.[12]
Ovulación[editar]

En un ciclo de 28 días se presenta entre el decimocuarto y el decimoquinto día del ciclo. El ovocito es liberado del ovario y es conducido hasta el útero a través de la trompa de Falopio (Tuba Uterina).
Durante la fase folicular, el estradiol suprime la producción de hormona luteinizante (LH) desde la glándula pituitaria anterior. Cuando el óvulo está a punto de llegar a la madurez, los niveles de estradiol llegan a un umbral sobre el que este efecto se revierte y el estrógeno estimula la producción de una gran cantidad de hormona luteinizante. Este proceso, conocido como pico de hormona luteinizante, comienza alrededor del día 12 de un ciclo medio y puede durar 48 horas.
Aún no se entiende cómo funciona el mecanismo exacto de estas respuestas opuestas de la hormona luteinizante frente al estradiol.[13]:86 En animales, una oleada de GnRH precede a la de la hormona luteinizante, lo que sugiere que el mayor efecto del estrógeno está en el hipotálamo, que controla a su vez la secreción de GnRH.[13]:86 Esto se da por la presencia de dos tipos de receptores de estrógeno en el hipotálamo: el receptor de estrógeno alfa, responsable de la respuesta negativa en el ciclo estradiol-LH, y el receptor de estrógeno beta, responsable de la relación positiva entre el estradiol y la LH.[14] Sin embargo, en humanos, altos niveles de estradiol pueden provocar aumentos abruptos de LH, incluso cuando los niveles de GnRH y la frecuencia del pulso son constantes,[13]:86 sugiriendo que el estrógeno actúa directamente en la pituitaria para provocar la oleada de LH.
Este pico de LH es el que produce la ovulación, pues provoca la activación de genes proinflamatorios que debilitan y rompen la pared folicular, causando que el folículo libere su ovocito secundario.
Cuál de los dos ovarios ovulará cada vez, si el derecho o el izquierdo, parece ser aleatorio, y no se sabe si existe una coordinación entre ambos lados.[15] En ocasiones, ambos ovarios liberan un óvulo,[15] si ambos son fecundados, se dan como resultado hermanos gemelos[16] (gemelos di-cigóticos, también llamados mellizos).
Tras ser liberado del ovario al espacio peritoneal, el ovocito es captado por las trompas de Falopio a través de la fimbria o franja ovárica, que es un tejido ubicado al final de cada trompa de Falopio. Al cabo de aproximadamente un día, un ovocito sin fecundar se desintegra y se expulsa por el sangrado vaginal de la siguiente menstruación, comenzando así un nuevo ciclo.[11] En cambio, si se produce la fecundación el ovocito completa su maduración, dando lugar al óvulo maduro.
La fecundación por un espermatozoide suele ocurrir en la ampolla, la sección más ancha de las trompas de Falopio. Un óvulo fecundado comienza inmediatamente el proceso de embriogénesis o desarrollo. Este embrión en desarrollo tarda unos tres días en llegar al útero y otros tres para arraigar en el endometrio.[11] Para entonces suele haber llegado al estadio de blastocisto.
En algunas mujeres, la ovulación provoca unos dolores característicos llamados mittelschmerz (término alemán que significa dolor de en medio).[5] El cambio súbito hormonal durante la ovulación también puede causar en ocasiones sangrado a mitad de ciclo.[17]
Postovulación[editar]
También conocida como fase lútea o fase secretora. Suele durar del 16.º hasta el 28.º día del ciclo.[18]
El cuerpo lúteo, que procede del folículo de Graaf después de liberar al ovocito, juega un papel importante en esta fase. Este cuerpo continúa creciendo un tiempo tras la ovulación y produce cantidades significativas de hormonas, particularmente progesterona.[11] La progesterona juega un rol vital haciendo al endometrio receptivo para la implantación del blastocisto y para que sirva de soporte durante el inicio del embarazo; como efecto secundario eleva la temperatura basal de la mujer. Además, produce una miorelajación de la musculatura lisa para facilitar la implantación del embrión; esta relajación trae como consecuencia una disminución de la tensión, sueño, y un ligero estreñimiento. Otro efecto importante de la progesterona es un aumento de la tensión mamaria debido al aumento de tamaño y crecimiento glandular.[19]
Por otro lado, detiene la producción de FSH y LH que necesita para mantenerse, por lo que los niveles de progesterona decrece y el cuerpo lúteo se atrofia.[11] Los niveles en caída de progesterona desencadenan la menstruación y el inicio del siguiente ciclo. Desde la ovulación hasta la bajada de progesterona que provoca la menstruación suelen pasar dos semanas. La fase folicular suele variar en cada mujer de ciclo a ciclo, contrastando con la fase lútea, que se mantiene igual.[20]
Si el óvulo es fecundado, los niveles de progesterona se mantienen y, por lo tanto, no se pierde el cuerpo lúteo. Además, el embrión resultante produce gonadotropina coriónica humana (hCG), muy similar a la hormona luteinizante, permitiendo que se conserve el cuerpo lúteo. Dado que esta hormona solo se produce por el embrión, la mayoría de pruebas de embarazo buscan la presencia de esta hormona.[11]
Duración del ciclo[editar]
Aunque mucha gente cree que el ciclo menstrual medio dura unos 28 días, un estudio a gran escala de más de 30 000 ciclos de más de 2300 mujeres reveló que el ciclo medio dura 29,1 con una desviación estándar de siete días y medio y un intervalo de predicción de entre 15 y 45 días.[21] En este estudio, el subgrupo de datos con duraciones de ciclo entre 15 y 45 días tenía una media de 28,1 días con una desviación estándar de cuatro días. Un estudio de menor escala de 140 mujeres realizada en 2006 halló una media de 28,9 días.[22]
La variabilidad de la duración del ciclo menstrual es mayor en mujeres por debajo de los veinticinco años y menor en mujeres de 35 y 39 años.[21] La variabilidad se vuelve a incrementar en mujeres de 40 a 44 años.[23] Normalmente, variaciones de la duración del ciclo entre ocho y veinte días se considera una irregularidad moderada, y una variación de 21 días o más se considera muy irregular.[23]
Durante mucho tiempo se ha creído que la duración del ciclo está asociada con la luna. En 1979 un estudio de 305 mujeres reveló que aproximadamente un tercio de los sujetos tenía ciclos menstruales lunares, por ejemplo, una duración media de ciclo de 29,5 días más o menos un día. Al menos dos tercios de los sujetos comenzaron su ciclo en la mitad brillante del ciclo lunar, a pesar de que se esperaba una distribución aleatoria.[24] Otro estudio reveló que un número significante de menstruaciones comenzaba en luna nueva.[25]
Período fértil[editar]
El periodo más fértil (el momento con mayor probabilidad de embarazo como resultado de un encuentro sexual) se da en algún momento entre cinco días antes y uno o dos días después de la ovulación.[26] En un ciclo de 28 días con una fase luteal de 14, este momento corresponde a la segunda semana, y el inicio de la tercera. Se ha desarrollado una gran variedad de métodos para ayudar a las mujeres a saber los días del ciclo en los que son más fértiles o infértiles. Estos sistemas se conocen como métodos de conocimiento de la fertilidad.
El método que mide el índice de fertilidad basado únicamente en la duración del ciclo se llama método Ogino-Knaus.[27] Los métodos que requieren la observación de uno o más de los tres signos de fertilidad (temperatura basal, moco cervical y posición cervical)[28] son conocidos como métodos basados en síntomas.[27] Los sets disponibles para análisis de orina detectan el aumento de hormona luteinizante que se da entre 24 a 36 horas antes de la ovulación, son los llamados kits predictores de ovulación.[29] También existen los llamados monitores de fertilidad, que son aparatos computarizados que interpretan la temperatura basal, los resultados del análisis de orina o los cambios en la saliva.
La fertilidad de la mujer también es afectada por su edad.[30][31] Como la reserva total de óvulos de una mujer se forma en su etapa fetal[32] para ser ovulados decenios después, se ha sugerido que esta vida tan larga puede hacer que la cromatina de los óvulos sea más vulnerable a problemas de división, rupturas y mutaciones que la cromatina del esperma, que se produce de manera continua durante la vida reproductiva del hombre. Sin embargo, a pesar de esta hipótesis, se ha observado un envejecimiento similar en ambos casos.
La última menstruación[editar]
La última menstruación se conoce como menopausia, etapa en que la mujer deja de menstruar. La edad promedio en la que ocurre la menopausia es 51,4 años.[33] Sin embargo, la edad de la menopausia varía de mujer a mujer, y es, en general, entre 40 y 55. Este último sangrado es precedido por el climaterio, que es la fase de transición entre la etapa reproductiva y no reproductiva de la mujer. Sin embargo, desde el último consenso de la OMS (Organización Mundial de la Salud) se recomienda abandonar el término climaterio para evitar confusiones y se sustituye por el término perimenopausia.
Desórdenes en el ciclo menstrual[editar]
La ovulación irregular se llama oligoovulación .[34] La ausencia de ovulación se llama anovulación. Se puede tener la menstruación sin una ovulación que la preceda: un ciclo anovulatorio. En algunos ciclos, el desarrollo folicular puede empezar pero no completarse, sin embargo, los estrógenos formarán y estimularán el revestimiento uterino. El flujo anovulatorio surge de un endometrio muy grueso, provocado por tener de forma continuada unos niveles altos de estrógenos. Este flujo se llama sangrado intermenstrual de estrógeno. El sangrado anovulatorio desencadenado por un descenso brusco de los niveles de estrógeno se llama cambios.[35] Los ciclos anovulatorios suelen ocurrir antes de la menopausia (perimenopausia) y en mujeres con síndrome de ovario poliquístico.[36]
El flujo excesivamente escaso (menos de 10 ml) se llama hipomenorrea. Los ciclos de menos de 21 días o menos son proiomenorrea. La menstruación frecuente pero irregular es conocida como metrorragia. El sangrado repentino y abundante en cantidades mayores de 80 ml es llamado menorragia.[37] La menstruación abundante que ocurre de forma frecuente e irregular es menometrorragia. El término para los ciclos que exceden los 35 días es opsomenorrea.[38] La amenorrea es la ausencia de menstruación de tres[37] a seis[38] meses (sin estar embarazada) durante los años reproductivos.
George Preti, un químico orgánico del Monell Chemical Senses Center de Filadelfia y Winnefred Cutler, del departamento de psicología de la Universidad de Pensilvania, descubrieron que las mujeres con ciclos menstruales irregulares, al ser expuestas a extracto de sudor masculino, se volvían regulares.[39] Una explicación posible podría ser que las axilas contienen feromonas, tal y como pasa con otros mamíferos.[39]
Supresión de la ovulación[editar]
Anticoncepción hormonal[editar]

Mientras que algunos métodos anticonceptivos no afectan al ciclo menstrual, los hormonales funcionan interrumpiéndolo. La realimentación negativa de progesterona disminuye la frecuencia de pulso de la hormona liberadora de gonadotrofina (GnRH) que libera el hipotálamo y hace que decrezca el pulso de la hormona foliculoestimulante (FSH) y de la hormona luteinizante (LH) generadas por la glándula pituitaria. Los bajos niveles de FSH inhiben el desarrollo folicular, previniendo un aumento en los niveles de estradiol. La realimentación negativa de progesterona y la falta realimentación positiva de estrógeno durante la liberación de LH previenen la oleada de LH de medio ciclo. La inhibición del desarrollo folicular y la ausencia de LH previenen la ovulación.[40][41][42]
El grado de supresión de la ovulación en los anticonceptivos de solo progestágeno depende de la actividad del progestágeno y de la dosis. Dosis bajas de anticonceptivos de progestágeno, las clásicas pastillas, los implantes subdérmicos Norplant y Jadelle y el sistema intrauterino Mirena, inhiben la ovulación en el 50 % de los ciclos y su efectividad anticonceptiva recae principalmente en otros efectos, como el engrosamiento del moco cervical.[43] Los anticonceptivos de solo progestágeno de dosis media, la pastilla Cerazette y el implante subdérmico Nexplanon, permiten algo de desarrollo folicular, pero inhiben la ovulación en el 97-99 % de los ciclos. Se dan los mismos cambios en el moco cervical que con dosis bajas de progestágeno. Los de dosis altas, como los inyectables Depo Provera y Noristerat, inhiben totalmente el desarrollo folicular y la ovulación.[43]
Los anticonceptivos hormonales combinados llevan estrógeno y progestágeno. La realimentación negativa de estrógeno en la hipófisis hace que decrezca la emisión de FSH, lo que hace este tipo de anticonceptivos más eficaces a la hora de inhibir el desarrollo folicular y la ovulación. El estrógeno también reduce la incidencia de sangrado intermenstrual.[40][41][42] Varios anticonceptivos hormonales combinados, la píldora, NuvaRing y los parches, se suelen usar de forma que provocan sangrado. En un ciclo normal, la menstruación se da ante una caída repentina de los niveles de estrógeno y progesterona.[19] La discontinuidad temporal del uso de estos anticonceptivos (una semana de placebo o dejar de usarlos una semana) tiene un efecto similar, haciendo que la pared uterina sangre. Si no se desea este sangrado, se deberán tomar los anticonceptivos hormonales combinados continuamente, aunque esto aumenta el riesgo de sangrado.
Amenorrea lactacional[editar]
La lactancia materna causa una realimentación negativa en el pulso de la secreción de la hormona liberadora de gonadotropina (GnRH) y la hormona luteinizante (LH). Dependiendo de la fuerza de esta realimentación negativa, las mujeres que dan el pecho pueden experimentar la completa supresión del desarrollo folicular, desarrollo folicular pero no ovulación o ciclos normales.[44] La supresión de la ovulación es más frecuente cuando se da el pecho más frecuentemente.[45] La producción de prolactina en respuesta al amamantamiento es importante para mantener la amenorrea lactacional.[46] Como media, las mujeres que dan el pecho frecuentemente experimentan el regreso de la menstruación unos catorce meses y medio después del parto. Hay un amplio rango de respuesta individual, algunas experimentan la vuelta de la menstruación a los dos meses y otras permanecen amenorreicas hasta 42 meses.[47]
Efectos en otros sistemas[editar]
Algunas mujeres con enfermedades neurológicas han experimentado un incremento en la actividad de sus enfermedades durante su ciclo menstrual. Por ejemplo, el descenso de los niveles de estrógeno puede desencadenar migrañas,[48] especialmente cuando la mujer que las sufre está tomando la píldora anticonceptiva. Muchas mujeres con epilepsia tienen más convulsiones en un patrón relacionado con el ciclo menstrual. A esto se le llama epilepsia catamenial.[49] Al parecer existen diferentes patrones (las convulsiones pueden coincidir con la menstruación o con la ovulación) y la frecuencia de las convulsiones no es siempre la misma. Usando una definición particular, un grupo de científicos descubrió que un tercio de las mujeres con epilepsia parcial intratable tienen epilepsia catamenial.[49][50][51] El descenso de progesterona y el aumento estrógeno podría provocar las convulsiones.[52] Estudios recientes han mostrado que altas dosis de estrógenos pueden causar o empeorar las convulsiones, mientras que altas dosis de progesterona pueden servir como medicamento antiepiléptico.[53] Según estudios de publicaciones médicas las mujeres menstruando son 1,68 veces más propensas a cometer suicidio.[54] Se han usado ratones en un sistema experimental para investigar los posibles mecanismos mediante los que los niveles de la hormona esteroide sexual puedan regular las funciones del sistema nervioso. Durante parte del celo, cuando la progesterona está alta, el nivel de neuronas receptoras GABA A subtipo delta era alto. Como estos receptores son inhibidores, las neuronas con más receptores delta tienen menos probabilidades de usarse que las que tienen menos. Durante la parte del celo en la que los estrógenos estaban más altos que la progesterona, el número de receptores delta decrecía, incrementando el nivel de actividad neuronal, aumentando a su vez la ansiedad y la susceptibilidad a las convulsiones.[55]
Los niveles de estrógeno pueden afectar al comportamiento de la tiroides.[56] Por ejemplo, durante la fase lútea (cuando los niveles de estrógeno son bajos), la velocidad de la sangre en la tiroides es menor que durante la fase folicular (durante la que los niveles de estrógeno son mayores).[57]
Entre las mujeres que viven juntas, el inicio de la menstruación tiende a sincronizarse. Este efecto fue descrito por vez primera en 1971 y se halló una posible explicación en 1998, por el efecto de las feromonas.[58] Las subsiguientes investigaciones han llevado a replantear esta hipótesis.[59]
Asociaciones biológicas y etimológicas[editar]
La palabra "menstruación" está relacionada etimológicamente con la luna, deriva del latín mensis, mes, que a su vez proviene del griego mene, luna.[60]
Algunos autores creen que históricamente, las mujeres de sociedades tradicionales sin iluminación nocturna ovulaban con la luna llena y menstruaban con la luna nueva,[61] y un autor documenta los controvertidos intentos de usar esta asociación para mejorar el método del calendario para regular la concepción.[60][62]
Unos pocos estudios en humanos[63] y otros animales[64] han descubierto que la luz artificial nocturna, influye en el ciclo menstrual en humanos y en el celo de los ratones (los ciclos son más regulares en ausencia de luz artificial nocturna). Se ha sugerido a su vez que la luz intensa por las mañanas ayuda a regular el ciclo.[65] Un autor ha sugerido que la sensibilidad de los ciclos femeninos a la luz nocturna es causada por deficiencias nutricionales de ciertas vitaminas y minerales.[66]
Algunos estudios muestran una correlación entre el ciclo menstrual humano y el ciclo lunar, mientras que un meta análisis de los estudios desde 1996 no muestra ninguna correlación.[67][68][69][70][71][72] El pueblo Dogón no tiene alumbrado eléctrico y pasan la mayoría de las noches en el exterior de sus casas, hablando y durmiendo, por lo que fueron el ideal de población para detectar la influencia lunar, la cual, pese a todo, no se halló.[73]
La influencia del ciclo menstrual en el síndrome de abstinencia del hábito tabáquico[editar]
En España, según datos del Instituto Nacional de Estadística (INE), el número de fumadores ha aumentado un 3,3 % entre 2017 y 2019, hasta situarse en el 23,3 % de la población. Por sexo y para el año 2020 supone un porcentaje de fumadores del 23,3 % en los hombres y el 16,4 % en las mujeres.[74][75]
Hay numerosas técnicas para dejar el hábito tabáquico, como terapias de grupo, parches, chicles y meditación. Pero, además, en el caso de las mujeres, intentar dejar de fumar durante determinados días del mes puede hacer que conseguirlo sea más fácil, según datos obtenidos en un estudio de la Universidad de Pensilvania y de la Universidad de Montreal.
Dichos estudios se enfocaron en: comprobar si existen diferencias en los circuitos neuronales vinculados a la compulsividad de fumar según el sexo y determinar si los cambios en la actividad cortical asociados con la abstinencia a la nicotina fluctúan en consonancia con las variaciones hormonales producidas durante el ciclo menstrual.
Los resultados obtenidos en estos estudios realizados con MRI y, teniendo en cuenta el día del ciclo femenino, muestran que, aunque no existen diferencias significativas entre los hombres y las mujeres en relación con los circuitos neuronales involucrados en el deseo excesivo de fumar, sí observaron que los patrones de activación neuronal en las mujeres variaban considerablemente a lo largo de su ciclo menstrual. En concreto, ciertas áreas de sus cortezas frontal, temporal y parietal mostraron una mayor activación durante la fase folicular, mientras que durante la fase lútea se registraba una actividad reducida en el hipocampo.
Adrianna Mendrek, autora principal del estudio llevado a cabo por la Universidad de Montreal explica: "Nuestros resultados revelan que los impulsos incontrolados por fumar son más fuertes al comienzo de la fase folicular. Las disminuciones hormonales de estrógenos y progesterona posiblemente acentúan el síndrome de abstinencia y aumentan la actividad de los circuitos neuronales asociados con el deseo de fumar". Según la científica, para las mujeres podría resultar más fácil superar los síntomas relacionados con la abstinencia tabáquica durante la fase lútea media, es decir, después de la ovulación, cuando se elevan los niveles de estrógeno y progesterona.
Véase también[editar]
Referencias[editar]
- ↑ Greenfield, Marjorie (17 de septiembre de 2001). «Subchorionic Hematoma in Early Pregnancy». Ask Our Experts. DrSpock.com. Archivado desde el original el 15 de septiembre de 2008. Consultado el 21 de septiembre de 2008.
- ↑ Anderson-Berry, Ann L.; Terence Zach (10 de diciembre de 2007). «Vanishing Twin Syndrome». Emedicine.com (WebMD). Consultado el 21 de septiembre de 2008.
- ↑ Ko, Patrick; Young Yoon (23 de agosto de 2007). «Placenta Previa». Emedicine.com (WebMD). Consultado el 21 de septiembre de 2008.
- ↑ «Menstruation and the Menstrual Cycle». Womenshealth.gov. April 2007. Archivado desde el original el 24 de octubre de 2008.
- ↑ a b c John M Goldenring (1 de febrero de 2007). «All About Menstruation». WebMD. Consultado el 5 de octubre de 2008.
- ↑ David L Healy (24 de noviembre de 2004). «Menorrhagia Heavy Periods - Current Issues». Monash University. ABN 12 377 614 012. Archivado desde el original el 16 de octubre de 2013.
- ↑ Harvey LJ.; Armah CN.; Dainty JR. et al. (octubre de 2005). «Impact of menstrual blood loss and diet on iron deficiency among women in the UK». The British journal of nutrition 94 (4): 557-64. PMID 16197581. doi:10.1079/BJN20051493. Consultado el 5 de octubre de 2008.
- ↑ Shiraishi M (agosto de 1962). «Studies on identification of menstrual blood stain by fibrin-plate method. I. A study on the incoagulability of menstrual blood». Acta Medica Okayama 16 (1): 192-200. PMID 13977381. Archivado desde el original el 9 de agosto de 2014. Consultado el 5 de octubre de 2008.
- ↑ Sharma P, Malhotra C, Taneja DK, Saha R (2008). "Problems related to menstruation amongst adolescent girls". Indian J Pediatr. 75 (2): 125–9. doi 10.1007/s12098-008-0018-5. PMID 18334791
- ↑ Hugo Parrales M.D. «Ciclo Menstrual femenino». Cerebro Medico. Consultado el 14 de enero de 2018.
- ↑ a b c d e f g h i Losos, Jonathan B.; Raven, Peter H.; Johnson, George B.; Singer, Susan R. (2002). Biology. New York: McGraw-Hill. pp. 1207–09. ISBN 0-07-303120-8.
- ↑ Weschler, Toni (2002). Taking Charge of Your Fertility (Revised edición). New York: HarperCollins. pp. 359–361. ISBN 0-06-093764-5.
- ↑ a b c Lentz, Gretchen M; Rogerio A. Lobo, MD, David M Gershenson, MD and Vern L. Katz, MD (2013). Comprehensive gynecology.. St. Louis: Elsevier Mosby. ISBN 978-0-323-06986-1. Consultado el 5 de abril de 2012.
- ↑ Hu L, Gustofson RL, Feng H, et al. (octubre de 2008). «Converse Regulatory Functions of Estrogen Receptor-α and -β Subtypes Expressed in Hypothalamic Gonadotropin-Releasing Hormone Neurons». Mol. Endocrinol. 22 (10): 2250-9. PMC 2582533. PMID 18701637. doi:10.1210/me.2008-0192.
- ↑ a b Ecochard R, Gougeon A (abril de 2000). «Side of ovulation and cycle characteristics in normally fertile women». Human reproduction (Oxford, England) 15 (4): 752-5. PMID 10739814. doi:10.1093/humrep/15.4.752.
- ↑ «Multiple Pregnancy: Twins or More - Topic Overview». WebMD Medical Reference from Healthwise. 24 de julio de 2007. Consultado el 5 de octubre de 2008.
- ↑ Weschler (2002), p.65.
- ↑ Ministerio de Educación - Proyecto Biosfera: «El ciclo menstrual». Consultado el 6 de julio de 2011.
- ↑ a b Weschler (2002), pp.361-2.
- ↑ Weschler (2002), p.47.
- ↑ a b Chiazze Jr, L.; Brayer, F. T.; MacIsco Jr, J. J.; Parker, M. P.; Duffy, B. J. (1968). «The length and variability of the human menstrual cycle». JAMA: the Journal of the American Medical Association 203 (6): 377-380. PMID 5694118. doi:10.1001/jama.203.6.377.[1]
- ↑ http://epublications.marquette.edu/cgi/viewcontent.cgi?article=1010&context=nursing_fac
- ↑ a b Kippley, John; Sheila Kippley (1996). The Art of Natural Family Planning (4th edición). Cincinnati, OH: The Couple to Couple League. p. 92. ISBN 0-926412-13-2.
- ↑ Friedmann, E (1981). «Menstrual and lunar cycles». American journal of obstetrics and gynecology 140 (3): 350. PMID 7246643.
- ↑ Law, Sung Ping (1986). «The Regulation of Menstrual Cycle and its Relationship to the Moon». Acta Obstetricia et Gynecologica Scandinavica 65 (1): 45-8. PMID 3716780. doi:10.3109/00016348609158228.
- ↑ Weschler (2002), pp.242, 374.
- ↑ a b Medical Eligibility Criteria for Contraceptive Use:Fertility awareness-based methods. Third edition. World Health Organization. 2004. Consultado el 29 de abril de 2008.
- ↑ Weschler (2002), p.52
- ↑
- En MedlinePlus hay más información sobre LH urine test (home test)
- ↑ [2]
- ↑ Leridon, Henri. «Can assisted reproduction technology compensate for the natural decline in fertility with age? A model assessment.» Human Reproduction. Consultado el 14 de noviembre de 2014.
- ↑ Krock, Lexi (octubre de 2001). «Fertility Throughout Life». 18 Ways to Make a Baby. NOVA Online. Consultado el 24 de diciembre de 2006. Haines, Cynthiac (enero de 2006). «Your Guide to the Female Reproductive System». The Cleveland Clinic Women's Health Center. WebMD. Consultado el 24 de diciembre de 2006.
- ↑ «¿Qué es la menopausia?» Asociación Española para el Estudio de la Menopausia. Consultado el 14 de noviembre de 2014.
- ↑ Galan, Nicole (16 de abril de 2008). «Oligoovulation». about.com. Archivado desde el original el 3 de marzo de 2016. Consultado el 12 de octubre de 2008.
- ↑ Weschler (2002), p.107
- ↑ Anovulation en eMedicine
- ↑ a b Menstruation Disorders en eMedicine
- ↑ a b Oriel KA, Schrager S (octubre de 1999). «Abnormal uterine bleeding». American Family Physician 60 (5): 1371-80; discussion 1381-2. PMID 10524483. Archivado desde el original el 10 de noviembre de 2011. Consultado el 12 de octubre de 2008.
- ↑ a b Looking for love potion number nine, Cathryn M. Delude, The Boston Globe, September 2, 2003.
- ↑ a b Trussell, James (2007). «Contraceptive Efficacy». En Hatcher, Robert A., et al., ed. Contraceptive Technology (19th rev. edición). New York: Ardent Media. ISBN 0-9664902-0-7.
- ↑ a b Speroff, Leon; Darney, Philip D. (2005). «Oral Contraception». A Clinical Guide for Contraception (4th edición). Filadelfia: Lippincott Williams & Wilkins. pp. 21–138. ISBN 0-7817-6488-2.
- ↑ a b Loose, Davis S.; Stancel, George M. (2006). «Estrogens and Progestins». En Brunton, Laurence L.; Lazo, John S.; Parker, Keith L. (eds.), ed. Goodman & Gilman's The Pharmacological Basis of Therapeutics (11th edición). New York: McGraw-Hill. pp. 1541–71. ISBN 0-07-142280-3.
- ↑ a b Glasier, Anna (2006). «Contraception». En DeGroot, Leslie J.; Jameson, J. Larry (eds.), ed. Endocrinology (5th edición). Filadelfia: Elsevier Saunders. pp. 3000-1. ISBN 0-7216-0376-9.
- ↑ McNeilly AS (2001). «Lactational control of reproduction». Reprod. Fertil. Dev. 13 (7–8): 583-90. PMID 11999309. doi:10.1071/RD01056.
- ↑ Kippley, John; Sheila Kippley (1996). The Art of Natural Family Planning (4th edición). Cincinnati, OH: The Couple to Couple League. p. 347. ISBN 0-926412-13-2.
- ↑ Stallings JF, Worthman CM, Panter-Brick C, Coates RJ (febrero de 1996). «Prolactin response to suckling and maintenance of postpartum amenorrhea among intensively breastfeeding Nepali women». Endocr. Res. 22 (1): 1-28. PMID 8690004. doi:10.3109/07435809609030495.
- ↑ «Breastfeeding: Does It Really Space Babies?». The Couple to Couple League International. Internet Archive. 17 de enero de 2008. Archivado desde el original el 17 de enero de 2008. Consultado el 21 de septiembre de 2008., which cites:
- Sheila K. and John F. Kippley (November–December 1972). «The relation between breastfeeding and amenorrhea». Journal of obstetric, gynecologic, and neonatal nursing 1 (4): 15-21. PMID 4485271.
- Sheila Kippley (November–December 1986 and January–February 1987). «Breastfeeding survey results similar to 1971 study». The CCL News 13 (3): 10. and 13(4): 5.
- ↑ Migraine and Estrogen Officially Linked | The Daily Headache
- ↑ a b Herzog AG (marzo de 2008). «Catamenial epilepsy: definition, prevalence pathophysiology and treatment». Seizure : the journal of the British Epilepsy Association 17 (2): 151-9. PMID 18164632. doi:10.1016/j.seizure.2007.11.014.
- ↑ Herzog AG, Harden CL, Liporace J, et al. (septiembre de 2004). «Frequency of catamenial seizure exacerbation in women with localization-related epilepsy». Annals of neurology 56 (3): 431-4. PMID 15349872. doi:10.1002/ana.20214.
- ↑ Herzog AG, Klein P, Ransil BJ (octubre de 1997). «Three patterns of catamenial epilepsy». Epilepsia 38 (10): 1082-8. PMID 9579954. doi:10.1111/j.1528-1157.1997.tb01197.x.
- ↑ Scharfman HE, MacLusky NJ (septiembre de 2006). «The Influence of Gonadal Hormones on Neuronal Excitability, Seizures, and Epilepsy in the Female». Epilepsia 47 (9): 1423-40. PMC 1924802. PMID 16981857. doi:10.1111/j.1528-1167.2006.00672.x. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Menstrual cycle | epilepsy.com
- ↑ Enrique Baca-García, Carmen Diaz-Sastre, Antonio Ceverino, Jeronimo Saiz-Ruiz, Francisco J. Diaz, and Jose de Leon, E; Diaz-Sastre, C; Ceverino, A; Saiz-Ruiz, J; Diaz, FJ; De Leon, J (March/April 2003). «Association Between the Menses and Suicide Attempts: A Replication Study». Psychosomatic Medicine 65 (2): 237-44. PMID 12651991. doi:10.1097/01.PSY.0000058375.50240.F6. Consultado el 2 de diciembre de 2008.
- ↑ Maguire JL, Stell BM, Rafizadeh M, Mody I (junio de 2005). «Ovarian cycle-linked changes in GABAA receptors mediating tonic inhibition alter seizure susceptibility and anxiety». Nat. Neurosci. 8 (6): 797-804. PMID 15895085. doi:10.1038/nn1469. Archivado desde el original el 2 de octubre de 2008.
- ↑ Doufas AG, Mastorakos G (2000). «The hypothalamic-pituitary-thyroid axis and the female reproductive system». Annals of the New York Academy of Sciences 900: 65-76. PMID 10818393. doi:10.1111/j.1749-6632.2000.tb06217.x.
- ↑ Krejza J, Nowacka A, Szylak A, Bilello M, Melhem LY (julio de 2004). «Variability of thyroid blood flow Doppler parameters in healthy women». Ultrasound in medicine & biology 30 (7): 867-76. PMID 15313319. doi:10.1016/j.ultrasmedbio.2004.05.008.
- ↑ Stern K, McClintock MK (1998). «Regulation of ovulation by human pheromones». Nature 392 (6672): 177-9. PMID 9515961. doi:10.1038/32408.
- ↑ Adams, Cecil (20 de diciembre de 2002). «Does menstrual synchrony really exist?». The Straight Dope. The Chicao Reader. Consultado el 10 de enero de 2007.
- ↑ a b Allen, Kevin (2007). The Reluctant Hypothesis: A History of Discourse Surrounding the Lunar Phase Method of Regulating Conception. Lacuna Press. p. 239. ISBN 978-0-9510974-2-7.
- ↑ Cohen, Sari (February–March 2005). «Melatonin, menstruation, and the moon». Townsend Letter for Doctors and Patients. Consultado el 21 de septiembre de 2008.
Knight, Chris; Camilla Power & Ian Watts (1995). «The Human Symbolic Revolution: A Darwinian Account» (PDF). Cambridge Archaeological Journal 5 (1): 75-114. doi:10.1017/S0959774300001190. Archivado desde el original el 1 de agosto de 2020. Consultado el 13 de diciembre de 2006.
Lacey, Louise (1975). Lunaception: a feminine odyssey into fertility and contraception. New York: Coward, McCann & Geoghegan. ISBN 0-698-10674-1. - ↑ "[3]". Fertility and the Moon Phase Cycle Book reviews, information and research on lunar correlates in fertility cycles
- ↑ Singer, Katie. "Fertility Awareness, Food, and Night-Lighting". Wise Traditions in Food, Farming and the Healing Arts, Spring 2004. See section on Night-Lighting.
- ↑ Harder, Ben (Week of August 28, 2004). «Bright nights kindle cancers in mice». Science News 166 (9): 141.
- ↑ Danilenko KV, Samoilova EA (2007). «Stimulatory Effect of Morning Bright Light on Reproductive Hormones and Ovulation: Results of a Controlled Crossover Trial». PLoS clinical trials 2 (2): e7. PMC 1851732. PMID 17290302. doi:10.1371/journal.pctr.0020007.
- ↑ Shannon, Marilyn M. (2001). Fertility, cycles & nutrition : how your diet affects your menstrual cycles & fertility (3rd edición). Cincinnati, Ohio: Couple to Couple League International. pp. 71–2.
- ↑ As cited by Adams, Cecil, "What's the link between the moon and menstruation?" (accessed 6 June 2006):
Abell, George O.; Barry Singer (1983). Science and the Paranormal: Probing the Existence of the Supernatural. Scribner Book Company. ISBN 0-684-17820-6. - ↑ Cutler WB (agosto de 1980). «Lunar and menstrual phase locking». Am. J. Obstet. Gynecol. 137 (7): 834-9. PMID 7405975.
- ↑ Friedmann E (junio de 1981). «Menstrual and lunar cycles». Am. J. Obstet. Gynecol. 140 (3): 350. PMID 7246643.
- ↑ Law SP (1986). «The regulation of menstrual cycle and its relationship to the moon». Acta Obstet Gynecol Scand 65 (1): 45-8. PMID 3716780. doi:10.3109/00016348609158228.
- ↑ Zimecki M (2006). «The lunar cycle: effects on human and animal behavior and physiology». Postepy Hig Med Dosw (Online) 60: 1-7. PMID 16407788. Archivado desde el original el 9 de octubre de 2009.
- ↑ Kelly, Ivan; Rotton, James; Culver, Roger (1986). «The Moon Was Full and Nothing Happened: A Review of Studies on the Moon and Human Behavior». Skeptical Inquirer 10 (2): 129-43.. Reprinted in The Hundredth Monkey - and other paradigms of the paranormal, edited by Kendrick Frazier, Prometheus Books. Revised and updated in The Outer Edge: Classic Investigations of the Paranormal, edited by Joe Nickell, Barry Karr, and Tom Genoni, 1996, CSICOP.
- ↑ Strassmann B.I. (1997). «The biology of menstruation in Homo sapiens: total lifetime menses, fecundity, and nonsynchrony in a natural fertility population». Current Anthropology 38: 123-129.
- ↑ «Productos y Servicios / Publicaciones / Publicaciones de descarga gratuita». www.ine.es. Consultado el 11 de noviembre de 2021.
- ↑ «Consumo de tabaco según sexo y grupo de edad. Población de 15 y más años.». INE. Consultado el 11 de noviembre de 2021.
Enlaces externos[editar]
 Wikimedia Commons alberga una galería multimedia sobre Ciclo sexual femenino.
Wikimedia Commons alberga una galería multimedia sobre Ciclo sexual femenino.- Esquema del ciclo menstrual con imágenes.
