Fenilalanina
| Fenilalanina | ||
|---|---|---|
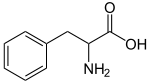 | ||
 | ||
| Nombre IUPAC | ||
| Ácido 2-amino-3-fenilpropanoico | ||
| General | ||
| Símbolo químico | Phe, F | |
| Fórmula estructural |
 | |
| Fórmula molecular | C9H11NO2 | |
| Identificadores | ||
| Número CAS | 63-91-2[1] | |
| ChEBI | 17295 | |
| ChEMBL | CHEMBL301523 | |
| ChemSpider | 5910 | |
| DrugBank | DB00120 | |
| PubChem | 994 | |
| UNII | 47E5O17Y3R | |
| KEGG | C00079 D00021, C00079 | |
|
C1=CC=C(C=C1)CC(C(=O)O)N
| ||
| Propiedades físicas | ||
| Masa molar | 16 519 g/mol | |
| Punto de fusión | 556 K (283 °C) | |
| Propiedades químicas | ||
| Acidez | 9,24 pKa | |
| Esencial | Sí | |
| Codón | UUC, UUU | |
| Punto isoeléctrico (pH) | 5,48 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La fenilalanina es un aminoácido (abreviado Phe o F). Se encuentra en las proteínas como L-fenilalanina (LFA), siendo uno de los 9 aminoácidos esenciales para el ser humano. La fenilalanina está presente también en muchos psicoactivos.
Historia[editar]
La primera descripción de la fenilalanina se hizo en 1879, cuando Schulze y Barbieri identificaron un compuesto con la fórmula empírica, C
9H
11NO
2, en plántulas de lupino amarillo (Lupinus luteus) . En 1882, Erlenmeyer y Lipp la sintetizaron por primera vez a partir de la fenilacetaldehıdo, cianuro de hidrógeno y amoníaco.[2][3]
El codón genético para la fenilalanina fue descubierto por primera vez por J. Heinrich Matthaei y Marshall W. Nirenberg en 1961. Mostraron que mediante el uso de ARNm para insertar múltiples uracilos repetidos en el genoma de la bacteria E. coli, podían causar que la bacteria produjese un polipéptido que consiste únicamente en aminoácidos de fenilalanina repetidos. Este descubrimiento ayudó a establecer la naturaleza de la relación de codificación que relaciona la información almacenada en el ácido nucleico genómico con la expresión de la proteína en la célula viva.
Bioquímica[editar]
La cadena lateral característica de este aminoácido contiene un anillo bencénico, y es por tanto uno de los aminoácidos aromáticos. Su uso excesivo produce efectos laxantes, junto con la tirosina y el triptófano. La L-fenilalanina se puede transformar, por medio de una reacción catalizada por la enzima fenilalanina hidroxilasa, en tirosina. La L-fenilalanina es también el precursor de las catecolaminas como la L-dopa (L-3,4-dihidroxifenilalanina), la norepinefrina y la epinefrina, a través de una etapa en la que se forma tirosina.
Por otro lado, la L-fenilalanina se encuentra en la estructura de neuropéptidos como la somatostatina, vasopresina, melanotropina, encefalina, hormona adrenocorticotrópica (ACTH), angiotensina, sustancia P y colecistoquinina.
La fenilalanina utiliza los mismos canales transportadores que el triptófano para atravesar la barrera hematoencefálica. En cantidades excesivas, la suplementación puede interferir con la producción de serotonina y otros aminoácidos aromáticos, como así también en la producción de óxido nítrico, debido al consumo excesivo de los cofactores asociados, hierro o tetrahidrobiopterina, Las correspondientes enzimas para la producción de estos compuestos son las de la familia de las aminoácido aromático hidroxilasas y óxido nítrico sintasas.

Fuentes de fenilalanina[editar]
La fenilalanina se ve principalmente en alimentos ricos en proteínas; tanto de origen animal como las carnes rojas, el pescado, huevo y productos lácteos; como de origen vegetal como los espárragos, garbanzos, lentejas, cacahuetes, soja. Asimismo se encuentra en muchas de las drogas psicotrópicas usadas habitualmente. La fenilalanina, debido a su anillo aromático no es edulcorante por sí mismo, necesita estar unido al ácido aspártico para este cometido.
La fenilalanina es parte de la composición del aspartamo, un edulcorante artificial que se encuentra en alimentos dietéticos y es muy habitual en bebidas refrescantes; no se recomienda el consumo de fenilalanina por embarazadas ni pacientes fenilcetonúricos. Debido a la fenilcetonuria, normalmente los productos que contienen aspartamo llevan una advertencia en el etiquetado sobre la presencia de fenilalanina. Se ha visto que la fenilalanina tiene la habilidad única de bloquear ciertas enzimas, las encefalinasas en el sistema nervioso central, que normalmente se encargan de degradar las hormonas naturales parecidas a la morfina. Estas hormonas se llaman endorfinas y encefalinas y actúan como potentes analgésicos endógenos. La fenilalanina es efectiva como tratamiento para el dolor de espalda baja, dolores menstruales, migrañas, dolores musculares, de artritis reumatoide y de osteoartritis. Asimismo es usada en tratamientos antidepresivos.
Patologías[editar]
La enfermedad genética fenilcetonuria se debe a la carencia de la enzima fenilalanina hidroxilasa o de la dihidropterina reductasa (DPHR), y esta deficiencia hace que la fenilalanina se degrade en una ruta metabólica alterna hacia fenilpiruvato, un neurotóxico que afecta gravemente al cerebro durante el crecimiento y el desarrollo. Los efectos de la acumulación de este neurotóxico causan oligofrenia fenilpirúvica, caracterizada por un cociente intelectual de alrededor de 50. También influye bastante al metabolismo. Una deficiencia en el metabolismo de la fenilalanina puede producir alcaptonuria, una enfermedad hereditaria que causa orinas negruzcas y frecuentes cálculos renales.[7]
Véase también[editar]
Referencias[editar]
- ↑ Número CAS
- ↑ Thorpe, T. E. (1913). A Dictionary of Applied Chemistry. Longmans, Green, and Co. pp. 191-193. Consultado el 4 de junio de 2012.
- ↑ Plimmer, R. H. A. (1912) [1908]. Plimmer, R. H. A.; Hopkins, F. G., ed. The Chemical Composition of the Proteins. Monographs on Biochemistry. Part I. Analysis (2nd edición). Londres: Longmans, Green and Co. pp. 93-97. Consultado el 4 de junio de 2012.
- ↑ Broadley KJ (March 2010). «The vascular effects of trace amines and amphetamines». Pharmacol. Ther. 125 (3): 363-375. PMID 19948186. doi:10.1016/j.pharmthera.2009.11.005.
- ↑ Lindemann L, Hoener MC (May 2005). «A renaissance in trace amines inspired by a novel GPCR family». Trends Pharmacol. Sci. 26 (5): 274-281. PMID 15860375. doi:10.1016/j.tips.2005.03.007.
- ↑ Wang X, Li J, Dong G, Yue J (February 2014). «The endogenous substrates of brain CYP2D». Eur. J. Pharmacol. 724: 211-218. PMID 24374199. doi:10.1016/j.ejphar.2013.12.025.
- ↑ por MedlinePlus (julio de 2007). «Alcaptonuria». Enciclopedia médica en español. Consultado el 11 de julio de 2008.

