Carburo de wolframio
| Carburo de wolframio | ||
|---|---|---|
 α-carburo de wolframio | ||
 | ||
| Nombre IUPAC | ||
| Carburo de tungsteno | ||
| General | ||
| Fórmula molecular | C | |
| Identificadores | ||
| Número CAS | 12070-12-1, 11130-73-7[1] | |
| Número RTECS | YO7350000, YO7525000, YO7700000 | |
| ChEBI | 82283 | |
| ChemSpider | 2006424 | |
| PubChem | 2724274 | |
|
[C-]#[W+]
| ||
| Propiedades físicas | ||
| Apariencia | Sólido lustroso gris-negruzco | |
| Densidad | 15 600 kg/m³; 15,6 g/cm³ | |
| Masa molar | 195,950931 g/mol | |
| Punto de ebullición | 6000 K (5727 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | Insoluble | |
| Termoquímica | ||
| S0gas, 1 bar | 32,1 J·mol–1·K | |
| Capacidad calorífica (C) | 39,8 J/(mol·K)[2] | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El carburo de wolframio o carburo de tungsteno es un compuesto formado por wolframio y carbono. Es un compuesto intersticial con composición química de W3C hasta W6C, perteneciente al grupo de los carburos. Se utiliza fundamentalmente, debido a su elevada dureza, en la fabricación de maquinarias y utensilios para trabajar el acero. De esta característica también recibe el nombre de «vidia» (en alemán Widia, como abreviatura de wie Diamant, «como el diamante»).[3]
Debido a su elevada dureza y escasa ductilidad, se elaboran piezas de este material en forma de polvo, añadiendo entre un 6 y un 10 % de cobalto. Los granos del carburo de wolframio empleados en el proceso suelen tener diámetros de aproximadamente 0,5 a 1 micrómetros. El polvo se prensa, y las piezas obtenidas se calientan a una presión de 10 000 a 20 000 bares, aproximadamente a 1600 °C (algo por debajo del punto de fusión del carburo). En estas condiciones, la masa se compacta por sinterización, actuando el cobalto como pegamento entre los granos del carburo.
El acabado final de las piezas solo se puede realizar con métodos abrasivos. También es posible mecanizarlo con máquinas de electroerosión de hilo o penetración.
El tipo de material formado de esta manera se conoce como cermet, sigla del inglés ceramic metal.
Historia[editar]
El carburo de wolframio fue descubierto por el químico y Premio Nobel francés Henri Moissan. Moissan adaptó el horno eléctrico para experimentos científicos y descubrió varios carburos, entre ellos el de silicio o carborundum (llamado en su honor moissanita). En 1897, buscando conseguir diamantes artificiales, mezcló partículas metálicas de wolframio y de azúcar (por su contenido de carbono), calentando la mezcla a alta temperatura. El resultado fue una masa azul oscura de una gran dureza: el carburo de wolframio. Sin embargo su extrema fragilidad lo hacía inoperante, si bien no obstante registró su descubrimiento e identificó los componentes.
Durante la Primera Guerra Mundial se hicieron algunos experimentos en Alemania, sinterizando partículas de carburo de wolframio. Se prensaron en varias formas a alta presión y se trataron térmicamente. De nuevo el producto resultante fue demasiado frágil para procesarlo industrialmente.
En 1907, la empresa estadounidense General Electric había conseguido, gracias al trabajo del ingeniero William Coolidge, desarrollar filamentos de wolframio, lo que permitió sustituir al rutenio y al osmio en la fabricación de bombillas de luz. Pero el wolframio resultó ser muy abrasivo, por lo que para el trefilado de los filamentos de bombillas se debía emplear diamante natural en las trefilas. Sin embargo los núcleos de diamante tenían el inconveniente del alto coste de la materia prima y la dificultad de encontrarlos en la Alemania de la postguerra, tras la pérdida de las colonias sudafricanas. Por ello, alrededor de 1920, el ingeniero Karl Schröter junto a su ayudante Baumhauer, comenzaron la búsqueda de un sustituto; aunque no sería hasta el año 1923 cuando unos ingenieros de la fábrica berlinesa de bombillas OSRAM (licenciada por General Electric) lograron sintetizar un producto a base de carburo de wolframio utilizando como aglomerante un 10 % de cobalto. El cobalto proporcionó tenacidad a la aleación resultante, lo que permitía su uso industrial, y con ello se alcanzó el objetivo de producir un «metal duro como el diamante» (en alemán Metall hart wie Diamant). Este proceso fue aplicado a otros carburos base de la industria de carburos cementados.
Síntesis[editar]
Existen varios métodos de síntesis. Veamos algunos de ellos.
Un método de obtención consiste en la reacción de wolframio metálico y carbono a 1400-2000 °C,[4] siendo la base del proceso:
El proceso comienza con wolframio (que en su estado nativo se presenta en forma de óxido) y negro de carbono. Inicialmente en la superficie del wolframio se produce la formación de partículas de monocarburo de wolframio a partir del cual se difunde en las partículas de carbono y forma una capa de composición W2C. Se toma la cantidad requerida y se mezclan los polvos en briquetas o rociados con grafito en contenedores de compactación y se colocan en el horno. Para la protección del polvo de la oxidación, la atmósfera de síntesis es hidrógeno el cual reacciona con el carbono a una temperatura de 1300 °C para dar acetileno. La formación de carburo de wolframio tiene lugar principalmente a través de la fase gaseosa debido al carbono contenido en los gases. Las reacciones de la carburación son:
O bien con monóxido de carbono por la reacción:
El proceso habitual de obtención de carburo de wolframio se lleva a cabo a una temperatura de 1300-1350 °C si el polvo de wolframio es fino, y 1600 °C si es grueso, durando el proceso de 1 a 2 horas. Los bloques resultantes de carburo de wolframio ligeramente sinterizados se trituran y se tamizan.
Existe una variante que en lugar de wolframio metálico utiliza WO3 directamente (es decir, el wolframio en su estado corriente en la naturaleza), mezclado con grafito, en un proceso de fusión a 900 °C; o bien en hidrógeno a 670 °C después de la carburación en una atmósfera de argón a 1000 °C.[5]
Otros métodos utilizan un proceso patentado llamado «de lecho fluido» en el cual reaccionan a baja temperatura wolframio metálico y WO3 con una mezcla de CO/CO2 y H2 entre 900 y 1200 °C.[6]
Otro método es el de deposición de vapor químico:[4]
- reacción de hexacloruro de wolframio con hidrógeno (como agente reductor) y metano (como la fuente de carbono) a 670 °C.
- reaccionar hexafluoruro de wolframio con hidrógeno (como agente reductor) y metanol (como fuente de carbono) a 350 °C.
Monocristales de carburo de wolframio[editar]
Se pueden obtener cristales simples de WC a partir de la masa fundida. Una mezcla de Co-40 % y WC se funde en un crisol de alúmina a 1600 °C y, después de la homogeneización de la temperatura, esta se reduce a 1500 °C a una velocidad de 1-3 °C/min, manteniéndose a esta temperatura durante 12 horas. Después la muestra se enfría y la matriz de cobalto se disuelve con ácido clorhídrico hirviendo. También se puede utilizar el método de Czochralski para producir grandes cristales individuales (1 cm).[7]
Propiedades químicas[editar]
Hay dos compuestos bien caracterizados de wolframio y carbono, WC y semicarburo wolframio, W2C. Ambos compuestos pueden estar presentes en los revestimientos y las proporciones pueden depender del método de recubrimiento.[8]
A altas temperaturas el WC se descompone en wolframio y carbono y esto puede ocurrir durante la pulverización térmica (proceso que tiene lugar a alta temperatura). Por ejemplo, en métodos de HVOF (combustible de oxígeno de alta velocidad) y HEP (plasma de alta energía).[9]
La oxidación de WC empieza a 500-600 °C.[4] Es resistente a ácidos y solo es atacado por el ácido fluorhídrico/ácido nítrico (HF/HNO3 mezclas superiores a la temperatura ambiente).[4] Reacciona con flúor gas a temperatura ambiente y con cloro por encima de 400 °C y no es reactivo con el H2 seco hasta su punto de fusión.[4] El WC finalmente pulverizado se disuelve fácilmente en soluciones acuosas de peróxido de hidrógeno.[10]
Propiedades físicas[editar]
El carburo de wolframio tiene una densidad de 15,66 g/cm³.[11] Un alto punto de fusión a 2870 °C, un punto de ebullición de 6000 °C a 1 atmósfera estándar (100 kPa).[12] Su conductividad térmica es de 84,02 W m-1 K-1,[13] y su coeficiente de expansión térmica de 5,8 µm•m-1•K-1.[14] Capacidad calórica: 200 - 480 J K-1 kg-1.
Es extremadamente duro, ocupando ~9 en la escala de Mohs, número Vickers de 1700 a 2400.[15] Tiene un módulo de Young de aproximadamente 550 GPa, un módulo de compresibilidad de 439 GPa,[16] y un módulo de cizalladura de 270 GPa.[14] Su resistencia a la tracción es de 344,8 MPa.[17] y 5300-7000 MPa de resistencia a compresión.
La velocidad de una onda longitudinal (la velocidad del sonido) a través de una varilla delgada de carburo de tungsteno es 6220 m/s.[18]
Con una baja resistividad eléctrica de ~2×10−7 ohm•m, su resistividad es comparable con el de algunos metales (por ejemplo, vanadio: 2 × 10 -7 Ohm•m).[4][19]
El WC se moja fácilmente tanto por níquel o cobalto fundidos.[20] Investigación del diagrama de fases del sistema de WC-Co muestra que WC y Co forman un seudo eutéctico binario. El diagrama de fases muestra también que hay llamados η-carburos con la composición (W, Co)6C que se puede formar y el hecho de que estas fases son frágiles es la razón por la cual el control del contenido de carbono en WC-Co metales duros es importante.[20]
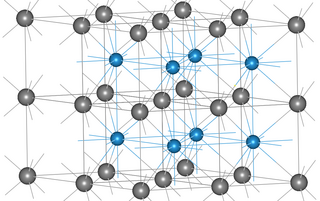
Estructura[editar]

Existen dos formas de WC, una estructura hexagonal, α-WC (hP2, grupo espacial P6m2, N.º 187),[21] estable a baja temperatura y una estructura cúbica, β-WC, similar a la de la sal gema, estable a alta temperatura.[22] La forma hexagonal se puede apreciar como capas de empaquetamiento compacto hexagonal de átomos de metal con capas que se extienden directamente la una sobre la otra, con átomos de carbono llenado medio de los intersticios dando tanto de wolframio y carbono en un habitual trigonal prismática, de coordinación 6.[21] A partir de las dimensiones de la celda unidad,[23] la distancia entre los átomos de wolframio en una capa hexagonal es de 291 pm, la distancia más corta entre los átomos de wolframio en capas adyacentes es 284 pm. La longitud de enlace entre el wolframio y el carbono es de 220 pm. Por consiguiente, la longitud de enlace de wolframio-carbono es comparable a la enlace sencillo en W(CH3)6 (218 pm) en la que hay fuertes perturbaciones coordinación prismática trigonal de wolframio.[24]
Se ha investigado el WC molecular. Esta especie en fase gaseosa tiene una longitud de enlace de 171 pm de 184W12C.[25]
Aplicaciones[editar]
Es un material estratégico. El gobierno estadounidense lo incluye dentro de los materiales de categoría vital junto a otros materiales y productos como el petróleo, lo que significa que se almacenan reservas para 6 meses, ante posibles fallos de suministro debido a fenómenos naturales o guerras.
Debido a su fragilidad no se emplea en estado puro sino en un compuesto de carburo cementado.
Herramientas de corte para el mecanizado[editar]
Las herramientas de corte de carburo de wolframio sinterizado son muy resistentes a la abrasión y también pueden soportar temperaturas más altas que las herramientas de acero de alta velocidad. Las superficies de corte de carburo se utilizan a menudo para el mecanizado de materiales tales como acero al carbono o acero inoxidable, así como en situaciones de uso intensivo, donde otras aleaciones durarían poco, tales como producción intensiva en serie. Debido a que las herramientas de carburo mantienen mejor que otras herramientas el borde de corte afilado, generalmente producen un acabado mejor de las partes, y su resistencia a la temperatura permite un mecanizado más rápido. El material generalmente se llama carburo cementado, cobalto metal duro o carburo de wolframio. Se trata de un compuesto de matriz metálica donde las partículas de carburo de wolframio están agregadas y el cobalto metálico es la matriz. Los fabricantes utilizan el carburo de wolframio como material principal en algunas brocas de alta velocidad, ya que puede resistir altas temperaturas y es extremadamente duro.[26][27] También se emplea en capas finísimas para recubrir filos de corte aumentando su resistencia al desgaste entre un 15 a un 30%.
Son estas herramienta comúnmente llamadas «de vidia», y se utilizan tanto en tornería como en matricería, en forma de herramientas de corte que resultan ser más eficientes que las de aceros al carbono o aceros rápidos (HSS), ya que mantienen su filo por más tiempo y pueden ser utilizadas a mayor velocidad (debido a su extremada dureza). La vidia se utiliza para la fabricación de las brocas o mechas utilizadas en mampostería.
Municiones[editar]
El carburo de wolframio se utiliza a menudo en munición perforante, en especial cuando no está disponible o es políticamente inaceptable el uso de uranio empobrecido. Se trata de un penetrador eficaz debido a su combinación de gran dureza y densidad muy alta.[28][29] (ver:capacidad de penetración) Los escuadrones de cazadores de carros de la Luftwaffe alemana emplearon los proyectiles de W2C por primera vez durante la Segunda Guerra Mundial.
La munición de carburo de wolframio puede ser de tipo sabot (una flecha grande rodeada por un cilindro de descarte de empuje) o un proyectil de calibre reducido, donde el cobre (u otro material relativamente blando) se utiliza para revestir el núcleo de penetración duro, separándose las dos partes en el impacto. Este último es más común en las armas de pequeño calibre, mientras que los sabot son generalmente empleados en cañones.[30][31]
Nuclear[editar]
El carburo de wolframio es también un eficaz reflector de neutrones y como tal fue utilizado durante las primeras investigaciones sobre las reacciones nucleares en cadena, en particular para las armas. Un accidente de criticidad se produjo en el Laboratorio Nacional de Los Álamos el 21 de agosto de 1945, cuando a Harry K. Daghlian, Jr. se le cayó un ladrillo de carburo de wolframio en una esfera de plutonio, haciendo que la masa subcrítica se convirtiera en supercrítica debido a los neutrones reflejados.
Deportes[editar]
Los deportistas emplean carburos duros, en especial de carburo de wolframio, en los bastones que golpean las superficies duras. Ejemplo de ello lo encontramos en la punta de los picos que utilizan los escaladores, que sufren un gran desgaste al clavarse en la piedra. Las puntas de carburo duran mucho más que otros tipos de punta[32]
Sin embargo, los bastones de esquí no utilizan este material, pues sus puntas no han de ser especialmente duras, incluso aunque se empleen para romper el hielo. Tampoco se emplea en los bastones de «skiroll», un deporte parecido al esquí de fondo y lo practican muchos esquiadores para entrenar en los meses cálidos.
Se puede encontrar pequeñas puntas afiladas de este metal en las cintas tractoras de las motos de nieve (llamados pernos), elementos destinados a mejorar la tracción sobre superficies heladas. Segmentos más largos en forma de V se pueden colocar en los esquís de las motos de nieve, con el objetivo de mejorar la gobernabilidad en superficies heladas. Las puntas de carburo reducen el desgaste cuando la moto de nieve debe cruzar caminos y otras superficies abrasivas.[33]
Algunos fabricantes ofrecen los neumáticos de bicicleta con tachuelas de carburo de wolframio para una mejor tracción sobre hielo. Estos se prefieren generalmente a las tachuelas de acero debido a su resistencia superior al desgaste.[34]
El carburo de wolframio puede usarse en herraduras de caballos, para mejorar la tracción en superficies resbaladizas como carreteras o hielo. Clavos de punta de carburo se pueden usar en la fabricación de zapatos,[35] o, alternativamente, boro, carburo de tungsteno en una matriz de metal más blando, que puede soldarse en pequeñas áreas de la parte inferior del zapato antes de su montaje.[36]
Instrumental quirúrgico[editar]
También se utiliza para la fabricación de instrumental quirúrgico destinados a la cirugía abierta (tijeras, pinzas, cuchillas, manijas, etc) y la cirugía laparoscópica (pinzas, tijeras/cortador, porta agujas, cauterizador, etc.) Son mucho más caros que sus homólogos de acero inoxidable y requieren un manejo delicado, pero dan un mejor rendimiento.[37]
Joyería[editar]
El carburo de wolframio, por lo general en forma de un carburo cementado (partículas de carburo unidas por un metal), se ha convertido en un material popular en la industria de la joyería nupcial, debido a su extrema dureza y alta resistencia al rayado. Si bien aunque es muy resistente su punto débil es cierta fragilidad.[38] El carburo de tungsteno es aproximadamente 10 veces más duro que el oro de 18 quilates. Además de su diseño y alto brillo, que forma parte de su atractivo para los consumidores es su carácter técnico.[39]
Otros[editar]
El carburo de wolframio se utiliza para fabricar la bola que gira en las puntas de los bolígrafos y similares que dispensan tinta durante la escritura.[40]
Es un material común usado en la fabricación de bloques patrón, que se utiliza como un sistema para producir longitudes de precisión en metrología dimensional.
El guitarrista inglés Martin Simpson es conocido el uso de un «slide guitar» de carburo de tungsteno hecho a medida.[41] La dureza, el peso y la densidad del dispositivo dan un mejor rendimiento en cuanto a volumen y persistencia, en comparación con el estándar de vidrio, acero, cerámica, o de bronce.
Se ha investigado su uso potencial como un catalizador y se ha encontrado para asemejarse al platino en su catálisis de la producción de agua a partir de hidrógeno y oxígeno a temperatura ambiente, la reducción de trióxido de tungsteno por el hidrógeno en la presencia de agua, y la isomerización de 2,2-dimetilpropano a 2-metilbutano.[42] Se ha propuesto como un reemplazo del catalizador de iridio para la hidrazina accionando propulsores de satélites.[43]
El carburo de wolframio se emplea, sobre todo, en la elaboración de utensilios de corte para trabajar metales o el acero. También se construyen algunas piezas que requieren elevada resistencia térmica o mecánica, como rodamientos de ejes, etc. Se emplea mucho engastado en las herramientas (trépanos) de perforación de pozos petroleros. También se usa muy frecuentemente en matricería. Su empleo en la fabricación moderna de todo tipo de máquinas y automóviles permite obtenerlos a un coste relativamente bajo.
Frente a los metales duros tiene la ventaja de mantener su dureza incluso a elevadas temperaturas. En los últimos años, también se han elaborado materiales parecidos a base de nitruro de titanio o carburo de titanio que incluso pueden tener una resistencia térmica más elevada.
Toxicidad[editar]
Los riesgos de salud principales en carburo se relacionan con la inhalación de polvo, dando lugar a fibrosis.[44] El cobalto-carburo de tungsteno también se anticipa razonablemente que sea un cancerígeno para el ser humano por el Programa Nacional de Toxicología de EE. UU.[45]
Referencias[editar]
- ↑ 11130-73-7 Número CAS
- ↑ Blau, Peter J. (2003). Wear of Materials. Elsevier. p. 1345. ISBN 978-0-08-044301-0.
- ↑ ASALE, RAE-. «vidia | Diccionario de la lengua española». «Diccionario de la lengua española» - Edición del Tricentenario. Consultado el 18 de enero de 2022.
- ↑ a b c d e f Pierson, Hugh O. (1992). Handbook of Chemical Vapor Deposition (CVD): Principles, Technology, and Applications. William Andrew Inc. ISBN 0-8155-1300-3.
- ↑ Zhong, Y.; et al. (2011). «A study on the synthesis of nanostructured WC–10 wt% Co particles from WO3, Co3O4, and graphite». Journal of Materials Science 46 (19): 6323. doi:10.1007/s10853-010-4937-y.
- ↑ Lackner, A. and Filzwieser A. "Gas carburizing of tungsten carbide (WC) powder" Patente USPTO n.º 6447742 (2002)
- ↑ Тот Л. (1974). Карбиды и нитриды переходных металлов. Мир. pp. 21-23. — 296 с.
- ↑ Jacobs, L.; M. M. Hyland; M. De Bonte (1998). «Comparative study of WC-cermet coatings sprayed via the HVOF and the HVAF Process». Journal of Thermal Spray Technology 7 (2): 213-218. doi:10.1361/105996398770350954.
- ↑ Nerz, J.; B. Kushner; A. Rotolico (1992). «Microstructural evaluation of tungsten carbide-cobalt coatings». Journal of Thermal Spray Technology 1 (2): 147-152. doi:10.1007/BF02659015.
- ↑ Noritaka Mizuno, Hitoshi Nakajima; Tetsuichi Kudo (1999). «Reaction of Metal, Carbide, and Nitride of Tungsten with Hydrogen Peroxide Characterized by 183W Nuclear Magnetic Resonance and Raman Spectroscopy». Chemistry of Materials 11 (3): 691-697. doi:10.1021/cm980544o.
- ↑ Page, Katharine; Li, Jun; Savinelli, Robert; Szumila, Holly N.; Zhang, Jinping; Stalick, Judith K.; Proffen, Thomas; Scott, Susannah L. et al. (de noviembre de 2008). «Reciprocal-space and real-space neutron investigation of nanostructured Mo2C and WC». Solid State Sciences 10 (11): 1499-1510. doi:10.1016/j.solidstatesciences.2008.03.018.
- ↑ Pohanish, Richard P. (2012). Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens. Sixth Edition. Kidlington, UK: Elsevier, Inc. p. 2670. ISBN 978-1-4377-7869-4.
- ↑ «Material: Tungsten Carbide (WC), bulk». MEMSnet. Consultado el 3 April 2013.
- ↑ a b Roylance, David. «Material Properties». Massachusetts Institute of Technology. Consultado el 4 de abril de 2013.
- ↑ CRC Materials Science and Engineering Handbook (2001).
- ↑ Lalena, John N.; Cleary, David A. (2010). Principles of Inorganic Materials Design (Second edición). Hoboken, New Jersey: John Wiley & Sons, Inc. p. 422. ISBN 978-0-470-40403-4.
- ↑ CRC Materials Science and Engineering Handbook, p.405
- ↑ «Velocity of Sound in Various Media». RF Cafe. Consultado el 4 April 2013.
- ↑ Kittel, Charles (1995). Introduction to Solid State Physics (7 edición). Wiley-India. ISBN 81-265-1045-5.
- ↑ a b Ettmayer, Peter; Walter Lengauer (1994). Carbides: transition metal solid state chemistry encyclopedia of inorganic chemistry. John Wiley & Sons. ISBN 0-471-93620-0.
- ↑ a b Wells, A. F. (1984). Structural Inorganic Chemistry (5 edición). Oxford Science Publications. ISBN 0-19-855370-6.
- ↑ Sara, R. V. (1965). «Phase Equilibria in the System Tungsten—Carbon». Journal of the American Ceramic Society 48 (5): 251-257. doi:10.1111/j.1151-2916.1965.tb14731.x.
- ↑ Rudy, E.; F. Benesovsky (1962). «Untersuchungen im System Tantal-Wolfram-Kohlenstoff». Monatshefte für chemie 93 (3): 1176-1195. doi:10.1007/BF01189609.
- ↑ Kleinhenz, Sven; Valérie Pfennig; Konrad Seppelt (1998). «Preparation and Structures of [W(CH3)6], [Re(CH3)6], [Nb(CH3)6]−, and [Ta(CH3)6]−». Chemistry—A European Journal 4 (9): 1687-91. doi:10.1002/(SICI)1521-3765(19980904)4:9<1687::AID-CHEM1687>3.0.CO;2-R.
- ↑ Sickafoose, S.M.; A.W. Smith; M. D. Morse (2002). «Optical spectroscopy of tungsten carbide (WC).». J. Chem. Phys. 116 (3): 993. doi:10.1063/1.1427068.
- ↑ Rao (2009). Manufacturing Technology Vol-Ii 2E. Tata McGraw-Hill Education. pp. 30-. ISBN 978-0-07-008769-9.
- ↑ Davis, Joseph R., ASM International. Handbook Committee (1995). Tool materials. ASM International. pp. 289-. ISBN 978-0-87170-545-7.
- ↑ Ford, Roger (2000). Germany's Secret Weapons in World War II. Zenith Imprint. pp. 125-. ISBN 978-0-7603-0847-9.
- ↑ Zaloga, Steven J. (2005). US Tank and Tank Destroyer Battalions in the ETO 1944–45. Osprey Publishing. pp. 37-. ISBN 978-1-84176-798-7.
- ↑ Green, Michael and Stewart, Greg (2005). M1 Abrams at War. Zenith Imprint. pp. 66-. ISBN 978-0-7603-2153-9.
- ↑ Tucker, Spencer (2004). Tanks: an illustrated history of their impact. ABC-CLIO. pp. 348-. ISBN 978-1-57607-995-9.
- ↑ Connally, Craig (2004). The mountaineering handbook: modern tools and techniques that will take you to the top. McGraw-Hill Professional. pp. 14-. ISBN 978-0-07-143010-4.
- ↑ Hermance, Richard (2006). Snowmobile and ATV accident investigation and reconstruction. Lawyers & Judges Publishing Company. pp. 13-. ISBN 978-0-913875-02-5.
- ↑ Hamp, Ron; Gorr, Eric and Cameron, Kevin (2011). Four-Stroke Motocross and Off-Road Performance Handbook. MotorBooks International. pp. 69-. ISBN 978-0-7603-4000-4.
- ↑ «Road nail». Mustad Hoof Nails. Archivado desde el original el 26 de marzo de 2012. Consultado el julio de 2011.
- ↑ Breningstall, F. Thomas. «Winter shoes». Windt im Wald Farm. Archivado desde el original el 23 de noviembre de 2012. Consultado el julio de 2011.
- ↑ Reichert, Marimargaret and Young, Jack H. (1997). Sterilization technology for the health care facility. Jones & Bartlett Learning. pp. 30-. ISBN 978-0-8342-0838-4.
- ↑ Breaking Tungsten Carbide. cherylkremkow.com (2009-10-29)
- ↑ Tungsten Carbide Manufacturing. forevermetals.com (2005-06-18)
- ↑ «How does a ballpoint pen work?». Engineering. HowStuffWorks. 1998-2007. Consultado el 16 de noviembre de 2007.
- ↑ «Wolfram Martin Simpson Signature Slide». Wolfram Slides. Consultado el 6 de agosto de 2013.
- ↑ Levy, R. B.; M. Boudart (1973). «Platinum-Like Behavior of Tungsten Carbide in Surface Catalysis». Science 181 (4099): 547-549. PMID 17777803. doi:10.1126/science.181.4099.547.
- ↑ Rodrigues, J.A.J.; G.M. Cruz; G. Bugli; M. Boudart; G. Djéga-Mariadassou (1997). «Nitride and carbide of molybdenum and tungsten as substitutes of iridium for the catalysts used for space communication». Catalysis Letters 45: 1-2. doi:10.1023/A:1019059410876.
- ↑ Sprince, NL.; Chamberlin, RI.; Hales, CA.; Weber, AL.; Kazemi, H. (Oct de 1984). «Respiratory disease in tungsten carbide production workers». Chest 86 (4): 549-57. PMID 6434250. doi:10.1378/chest.86.4.549.
- ↑ «12th Report on Carcinogens». National Toxicology Program. Archivado desde el original el 25 de junio de 2011. Consultado el 24 de junio de 2011.







