Diferencia entre revisiones de «Propano»
Sin resumen de edición Etiqueta: Revertido |
m Revertidos los cambios de 80.73.147.194 (disc.) a la última edición de Elías Etiqueta: Reversión |
||
| Línea 38: | Línea 38: | ||
}} |
}} |
||
El ''propano'' |
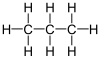
El ''propano'' (del [[Idioma griego|griego]] ''pro'' primer orden y ''pion'' grasa, y el sufijo químico ''-ano'' dado que todos sus enlaces son simples) es un [[gas]] incoloro e inodoro. Pertenece a los [[Hidrocarburo alifático|hidrocarburos alifáticos]] con enlaces simples de carbono, conocidos como [[Alcano]]s. Su fórmula química es [[Carbono|C]]<sub>3</sub>[[Hidrógeno|H]]<sub>8</sub>. |
||
== Generales == |
== Generales == |
||
Revisión del 10:29 19 abr 2021
| Propano | ||
|---|---|---|
 Modelo 3D del propano. | ||
 | ||
| Nombre IUPAC | ||
| Propano | ||
| General | ||
| Fórmula semidesarrollada | CH3CH2CH3 | |
| Fórmula estructural |
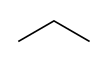 | |
| Fórmula molecular | C3H8 | |
| Identificadores | ||
| Número CAS | 74-98-6[1] | |
| Número RTECS | TX2275000 | |
| ChEBI | 32879 | |
| ChEMBL | CHEMBL135416 | |
| ChemSpider | 6094 | |
| PubChem | 24878140 | |
| UNII | T75W9911L6 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1,83 kg/m³; 0,00183 g/cm³ | |
| Masa molar | 44 g/mol | |
| Punto de fusión | 85,5 K (−188 °C) | |
| Punto de ebullición | 231,05 K (−42 °C) | |
| Temperatura crítica | 367,15 K (94 °C) | |
| Viscosidad | 0.2 cP (-40 ºC) | |
| Índice de refracción (nD) | 1.3407 (-42 ºC) | |
| Propiedades químicas | ||
| Solubilidad en agua | 80 mg/l a 20 °C | |
| Momento dipolar | 0.08 D | |
| Termoquímica | ||
| ΔfH0gas | -104.7±0.50 kJ/mol | |
| ΔfH0líquido | -119.8 ± 0.59 kJ/mol | |
| S0líquido, 1 bar | 171.0 J·mol–1·K–1 | |
| Peligrosidad | ||
| Punto de inflamabilidad | 169,15 K (−104 °C) | |
| NFPA 704 |
4
2
0
| |
| Temperatura de autoignición | 813,1 K (540 °C) | |
| Frases S | S2, S9, S16, | |
| Riesgos | ||
| Inhalación | Somnolencia y pérdida del conocimiento. Llevar al accidentado inmediatamente a un sitio al aire libre y mantenerlo en reposo. Respiración artificial si este estuviese indicado. Proporcionar asistencia médica | |
| Piel | En contacto con líquido: congelación. En caso de congelación, aclarar con abundante agua. No se debe quitar la ropa. Proporcionar asistencia médica | |
| Ojos | En contacto con líquido: congelación. En caso de congelación, enjuagar con abundante agua por varios minutos. Proporcionar asistencia médica | |
| Compuestos relacionados | ||
| Alcanos | Butano, Pentano, Metilpropano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El propano (del griego pro primer orden y pion grasa, y el sufijo químico -ano dado que todos sus enlaces son simples) es un gas incoloro e inodoro. Pertenece a los hidrocarburos alifáticos con enlaces simples de carbono, conocidos como Alcanos. Su fórmula química es C3H8.
Generales
Las mezclas de propano con el aire pueden ser explosivas con concentraciones del 1,8 al 9,3 % Vol de propano. La llama del propano, al igual que la de los demás gases combustibles, debe ser completamente azul; cualquier parte amarillenta, anaranjada o rojiza de la llama, denota una mala combustión. A temperatura ambiente es inerte frente a la mayor parte de los reactivos, aunque reacciona con el bromo, por ejemplo, en presencia de luz. En elevadas concentraciones el butano tiene propiedades narcotizantes.
Historia
El propano, molécula de 3 carbonos, se identificó como componente volátil en la gasolina por el Dr. Walter O. Snelling de la oficina de minas de EE. UU. en 1910. Debido a la volatilidad de estos hidrocarburos ligeros, fueron conocidos como "salvajes" ("wild" en inglés) por la gran presión de vapor en la gasolina no refinada. El 31 de marzo, el New York Times informó sobre el trabajo con gas licuado del Dr. Snelling y que "... una botella de acero de este gas será suficiente para alumbrar un hogar común durante tres semanas".
Fue durante este tiempo que Snelling, en colaboración con Frank P. Peterson, Kerr Chester, y Kerr Arthur, crearon formas para licuar los gases LP durante la refinación de la gasolina natural. Juntos fundaron americano Gasol Co., el primer vendedor de propano comercial. Snelling había producido propano relativamente puro en 1911, y el 25 de marzo de 1913 su método de procesamiento y producción de gases LP recibe una patente. Un método aparte de la producción de gas LP a través de la compresión fue creado por Frank Peterson y patentado en 1912.
La década de 1920 vio a una mayor producción de gas LP, con el primer año de producción registró un total de 223.000 galones (840 m³) en 1922. En 1927, la producción anual comercializada de gas LP alcanzó 1 millón de galones (3.800 m³), y para 1935, las ventas anuales habían llegado a 56 millones de galones estadounidenses (210.000 m³). Las principales novedades de la industria en la década de 1930 incluyeron la introducción del carro tanque de transporte, odorización del gas, y la construcción de plantas locales de llenado de botellas. El año 1945 marcó el primero en el que las ventas anuales alcanzaron los mil millones de galones. Para 1947, el 62% de los hogares de Estados Unidos habían sido equipados con gas natural o propano para cocinar.
En 1950, la Autoridad de Tránsito de Chicago, ordenó 1000 autobuses a propano y en 1958, las ventas en EE. UU. habían alcanzado 7 mil millones de galones estadounidenses (26 millones m³) anuales. En 2004 se informó de un incremento desde 8 mil millones a 10 mil millones, con unos 15 mil millones de galones estadounidenses (57 millones m³) de gas propano utilizados anualmente en los EE. UU.
La raíz "prop-" en su nombre y los de otros compuestos con cadenas de tres carbonos se derivan del "ácido propiónico".
Presión de vapor
En la siguiente tabla se muestra la Presión de vapor del propano en función de la temperatura:
| Temperatura (°C) | Presión (Pa) |
|---|---|
| 80 | 1 765 197 |
| 40 | 1 287 123 |
| 30 | 1 103 248 |
| 15 | 735 499 |
| 0 | 490 333 |
| -10 | 372 653 |
| -20 | 269 683 |
| -30 | 184 365 |
| -40 | 122 583 |
Síntesis
El propano se suele obtener del gas natural o de los gases de los procesos de "cracking" producidos en las instalaciones petroquímicas. En laboratorio se puede preparar por reducción de Clemmensen de la acetona.
Usos
El principal uso del propano es el aprovechamiento energético como combustible. Con base al punto de ebullición más bajo que el butano y el mayor valor energético por gramo, a veces se mezcla con este o se utiliza propano en vez de butano. En la industria química es uno de los productos de partida en la síntesis del propeno a través de la reacción de deshidrogenación[2]. Se realiza una investigación considerable para desarrollar procesos económicamente viables para la conversión oxidativa de propano en propileno[3][4][5][6] y ácido acrílico[7][8][9][10]. Además se utiliza como gas refrigerante (R290) o como gas propulsor en aerosoles.
Contenido energético
La entalpía de combustión del gas propano donde todos los productos vuelven al estado estándar, por ejemplo, donde el agua vuelve a su estado líquido a temperatura estándar (conocido como mayor valor de calentamiento), es (2219.2 ± 0.5) kJ / mol, o (50.33 ± 0.01 ) MJ / kg. [14] La entalpía de combustión del gas propano donde los productos no vuelven al estado estándar, por ejemplo donde los gases calientes, incluido el vapor de agua que sale de una chimenea (conocido como valor de calentamiento más bajo) es -2043.455 kJ / mol. [15] El valor de calor más bajo es la cantidad de calor disponible de la quema de la sustancia donde los productos de la combustión se ventilan a la atmósfera. Por ejemplo, el calor de una chimenea cuando la chimenea está abierta.
Densidad
La densidad del propano líquido a 25 ° C (77 ° F) es de 0,493 g / cm³, lo que equivale a 4,11 libras por galón líquido de los EE. UU. O 493 g / l. El propano se expande a 1.5% por 10 ° F. Por lo tanto, el propano líquido tiene una densidad de aproximadamente 4.2 libras por galón.
Véase también
- Metano
- Etano
- Butano
- Pentano
- Hexano
- Alcano
- 1,1,1-tribromopropano
- 1,1,2-tribromopropano
- 1,1-dibromopropano
- 2,2-dibromopropano
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Propano.
Wikimedia Commons alberga una galería multimedia sobre Propano.- Instituto nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del propano.
Referencias
- ↑ Número CAS
- ↑ Seo, Seung-Taek; Won, Wangyun; Lee, Kwang Soon; Jung, Chansul; Lee, Seokho (1 de noviembre de 2007). «Repetitive control of CATOFIN process». Korean Journal of Chemical Engineering (en inglés) 24 (6): 921-926. ISSN 0256-1115. doi:10.1007/s11814-007-0098-3. Consultado el 25 de diciembre de 2017.
- ↑ Hernández, Juan Pablo; Echavarría, Adriana; Palacio, Luz Amparo (June 2013). «Synthesis of two new Nickel and Copper- Nickel vanadates used for propane oxidative dehydrogenation». Revista Facultad de Ingeniería Universidad de Antioquia (67): 137-145. ISSN 0120-6230. Consultado el 25 de diciembre de 2017.
- ↑ Suárez, M. Natalia; Ríos, Luis A. (June 2013). «Oxidative dehydrogenation of propane with N2O over zeolite Cr/FeZSM-5». Ingeniería y competitividad 15 (1): 63-70. ISSN 0123-3033. Consultado el 25 de diciembre de 2017.
- ↑ Mesa, Santiago; Arboleda, Johana; Amaya, Sandra; Echavarría, Adriana (December 2012). «NiZnFe and NiMgFe hydrotalcites modified with V and Cr as precusors of catalysts for oxidative dehydrogenation of propane». Ingeniería y competitividad 14 (2): 169-178. ISSN 0123-3033. Consultado el 25 de diciembre de 2017.
- ↑ Barbero, B. P.; Prada Silvy, R.; Cadús, L. E. (October 2005). «Oxidative dehydrogenation of propane over (Mo)-Sm-V-O catalytic system: Role of the different phases». Latin American applied research 35 (4): 273-280. ISSN 0327-0793. Consultado el 25 de diciembre de 2017.
- ↑ «The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts». Journal of Catalysis 311: 369-385. 2014. Archivado desde el original el 15 de febrero de 2016.
- ↑ «Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol, 3(6), 1103-1113.». ACS Catalysis 3 (6): 1103-1113. 2013.
- ↑ «Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid». Journal of Catalysis (285): 48-60. 2012. Archivado desde el original el 30 de octubre de 2016.
- ↑ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts. 2011.

