Diferencia entre revisiones de «Hibridación (química)»
→Forma y ángulos: add image showing the shapes of hybrid orbitals |
→Forma y ángulos: introduce interorbital angle formulas and express interorbital angles as a function of hybridisation |
||
| Línea 97: | Línea 97: | ||
! AX<sub>2</sub> |
! AX<sub>2</sub> |
||
| |
| |
||
* [[Geometría molecular lineal|lineal]] |
* [[Geometría molecular lineal|lineal]] |
||
* hibridación sp |
* hibridación sp (180°) |
||
* E.g., CO<sub>2</sub> |
* E.g., CO<sub>2</sub> |
||
| style="background: silver;" | |
| style="background: silver;" | |
||
| Línea 105: | Línea 105: | ||
! AX<sub>3</sub> |
! AX<sub>3</sub> |
||
| |
| |
||
* [[Geometría molecular trigonal plana|trigonal plana]] |
* [[Geometría molecular trigonal plana|trigonal plana]] |
||
* hibridación sp<sup>2</sup> |
* hibridación sp<sup>2</sup> (120°) |
||
* E.g., BCl<sub>3</sub> |
* E.g., BCl<sub>3</sub> |
||
| |
| |
||
* [[Geometría molecular piramidal trigonal|piramidal trigonal]] |
* [[Geometría molecular piramidal trigonal|piramidal trigonal]] |
||
* hibridación sd<sup>2</sup> |
* hibridación sd<sup>2</sup> (90°) |
||
* E.g., CrO<sub>3</sub> |
* E.g., CrO<sub>3</sub> |
||
| style="background: silver;" | |
| style="background: silver;" | |
||
| Línea 116: | Línea 116: | ||
! AX<sub>4</sub> |
! AX<sub>4</sub> |
||
| |
| |
||
*[[Geometría molecular tetraédrica|tetraédrica]] |
*[[Geometría molecular tetraédrica|tetraédrica]] |
||
* hibridación sp<sup>3</sup> |
* hibridación sp<sup>3</sup> (109.5°) |
||
* E.g., CCl<sub>4</sub> |
* E.g., CCl<sub>4</sub> |
||
| |
| |
||
*[[Geometría molecular tetraédrica|tetraédrica]] |
*[[Geometría molecular tetraédrica|tetraédrica]] |
||
* hibridación sd<sup>3</sup> |
* hibridación sd<sup>3</sup> (70.5°, 109.5°) |
||
* E.g., TiCl<sub>4</sub> |
* E.g., TiCl<sub>4</sub> |
||
| |
| |
||
* [[Geometría molecular cuadrada plana|cuadrada plana]] |
* [[Geometría molecular cuadrada plana|cuadrada plana]] |
||
* hibridación sp<sup>2</sup>d |
* hibridación sp<sup>2</sup>d (109.5°, 180°) |
||
* E.g., PtCl<sub>4</sub><sup>2−</sup> |
* E.g., PtCl<sub>4</sub><sup>2−</sup> |
||
|----- |
|----- |
||
| Línea 131: | Línea 131: | ||
|style="background: silver;"| |
|style="background: silver;"| |
||
| |
| |
||
* ''C<sub>3v</sub>'' prisma trigonal |
* ''C<sub>3v</sub>'' prisma trigonal |
||
* hibridación sd<sup>5</sup> |
* hibridación sd<sup>5</sup> (63.4°, 116.6°) |
||
* E.g., W(CH<sub>3</sub>)<sub>6</sub> |
* E.g., W(CH<sub>3</sub>)<sub>6</sub> |
||
| |
| |
||
* [[Geometría molecular octaédrica|octaédrica]] |
* [[Geometría molecular octaédrica|octaédrica]] |
||
* hibridación sp<sup>3</sup>d<sup>2</sup> |
* hibridación sp<sup>3</sup>d<sup>2</sup> (90°, 180°) |
||
* E.g., Mo(CO)<sub>6</sub> |
* E.g., Mo(CO)<sub>6</sub> |
||
|----- |
|||
! ángulos interorbitales |
|||
! <math>\theta = \arccos (-\frac{1}{x})</math> |
|||
! <math>\theta = \arccos \left( \pm\sqrt{\frac{1}{3}(1-\frac{2}{x})} \right)</math> |
|||
! <math>\theta = \arccos \left(\frac{-x \pm\sqrt{x^2-6y+3y^2}}{3y} \right)</math> |
|||
|} |
|} |
||
| Línea 147: | Línea 152: | ||
|----- |
|----- |
||
! rowspan="2"| AX<sub>5</sub> |
! rowspan="2"| AX<sub>5</sub> |
||
| align="center"|[[Geometría molecular bipiramidal trigonal|bipiramidal trigonal]] |
| align="center"|[[Geometría molecular bipiramidal trigonal|bipiramidal trigonal]] |
||
|----- |
|----- |
||
| align="center" |[[Archivo:Penta phos.svg|400px]] |
| align="center" |[[Archivo:Penta phos.svg|400px]] |
||
|----- |
|----- |
||
! rowspan="2"| AX<sub>6</sub> |
! rowspan="2"| AX<sub>6</sub> |
||
| align="center"|[[Geometría molecular octaédrica|octaédrica]] |
| align="center"|[[Geometría molecular octaédrica|octaédrica]] |
||
|----- |
|----- |
||
| align="center" |[[Archivo:Hexa sulf.svg|400px]] |
| align="center" |[[Archivo:Hexa sulf.svg|400px]] |
||
|----- |
|----- |
||
! rowspan="2"| AX<sub>7</sub> |
! rowspan="2"| AX<sub>7</sub> |
||
| align="center"|[[Geometría molecular bipiramidal pentagonal|bipiramidal pentagonal]] |
| align="center"|[[Geometría molecular bipiramidal pentagonal|bipiramidal pentagonal]] |
||
|----- |
|----- |
||
| align="center" |[[Archivo:Hepta iodi.svg|400px]] |
| align="center" |[[Archivo:Hepta iodi.svg|400px]] |
||
Revisión del 23:48 11 may 2020

En química, se conoce como hibridación a la interacción de orbitales atómicos dentro de un átomo para formar nuevos orbitales híbridos. Los orbitales atómicos híbridos son los que se superponen en la formación de los enlaces, dentro de la teoría del enlace de valencia, y justifican la geometría molecular.
El químico Linus Pauling desarrolló por primera vez la teoría de la hibridación con el fin de explicar la estructura de las moléculas como el metano (CH4) en 1931.[1] Este concepto fue desarrollado para este tipo de sistemas químicos sencillos, pero el enfoque fue más tarde aplicado más ampliamente, y hoy se considera una heurística eficaz para la racionalización de las estructuras de compuestos orgánicos.
Hibridación sp3
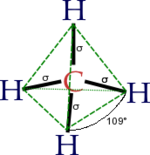
El átomo de carbono tiene seis electrones: dos se ubican en el orbital 1s (1s²), dos en el (2s²) y los restantes dos en el orbital 2p (2p²). Debido a su orientación en el plano tridimensional el subnivel 2p tiene capacidad para ubicar 6 electrones: 2 en el orbital px, dos en el orbital py y dos electrones en el orbital pz. Los dos últimos electrones del carbono se ubicarían uno en el 2px, el otro en el 2py y el orbital 2pz permanece vacío (2px¹ 2py¹). El esquema de lo anterior es (cada flecha un electrón):
Para satisfacer su energético inestable, un átomo de valencia como el del carbono, con orbitales parcialmente llenos (2px y 2py necesitarían tener dos electrones) tiende a formar enlaces con otros átomos que tengan electrones disponibles. Para ello, no basta simplemente colocar un electrón en cada orbital necesitado. En la naturaleza, este tipo de átomos redistribuyen sus electrones formando orbitales híbridos. En el caso del carbono, uno de los electrones del orbital 2s es extraído y se ubica en el orbital 2pz. Así, los cuatro últimos orbitales tienen un electrón cada uno:
El estímulo para excitar al electrón del 2s al 2pz es aportado por el primer electrón en formar enlace con un átomo con este tipo de valencia. Por ejemplo, el hidrógeno en el caso del metano. Esto a su vez incrementa la necesidad de llenado de los restantes orbitales. Estos nuevos orbitales híbridos dejan de ser llamados 2s y 2p y son ahora llamados sp3 (un poco de ambos orbitales):
De los cuatro orbitales así formados, uno (25%) es proveniente del orbital s (el 2s) del carbono y tres (75%) provenientes de los orbitales p (2p). Sin embargo todos se sobreponen al aportar la hibridación producto del enlace. Tridimensionalmente, la distancia entre un hidrógeno y el otro en el metano son equivalentes e iguales a un ángulo de 109,5°.
Hibridación sp2

Se define como la combinación de un orbital s y dos orbitales p, para formar 3 orbitales híbridos, que se disponen en un plano formando ángulos de 120º.
Los átomos que forman hibridaciones sp2 pueden formar compuestos con enlaces dobles. Forman un ángulo de 120º y su molécula es de forma plana. A los enlaces simples se les conoce como enlaces sigma (σ) y los enlaces dobles están compuestos por un enlace sigma y un enlace pi (). Las reglas de ubicación de los electrones en estos casos, como el alqueno etileno obligan a una hibridación distinta llamada sp2, en la cual un electrón del CEREBRO 2s se mezcla sólo con dos de los orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes
Tridimensionalmente, la distancia entre un hidrógeno y otro en algún carbono del etileno son equivalentes e iguales a un ángulo de 120°.
Hibridación sp

Se define como la combinación de un orbital s y un orbital p, para formar 2 orbitales híbridos, con orientación lineal. Este es el tipo de enlace híbrido, con un ángulo de 180º y que se encuentra existente en compuestos con triples enlaces como los alquinos (por ejemplo el acetileno):
Se caracteriza por la presencia de 2 enlaces pi (π).
Forma y ángulos
Las formas de las moléculas enlazadas por hibridaciones de sus orbitales es forzada por los ángulos entre sus átomos:

| molécula de tipo | elemento representativo/ metales de transición |
solo metales de transición | |
|---|---|---|---|
| hibridación spx | hibridación sdx | hibridación spxdy | |
| AX2 |
|
||
| AX3 |
|
|
|
| AX4 |
|
|
|
| AX6 |
|
| |
| ángulos interorbitales | |||
| molécula de tipo | elemento representativo |
|---|---|
| AX5 | bipiramidal trigonal |

| |
| AX6 | octaédrica |

| |
| AX7 | bipiramidal pentagonal |

|
Véase también
Referencias
- ↑ Pauling, L. (1931), «The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules», Journal of the American Chemical Society 53 (4): 1367-1400, doi:10.1021/ja01355a027.









