Diferencia entre revisiones de «Isomería»
m Revertidos los cambios de 186.104.180.10 a la última edición de 190.77.15.83 |
|||
| Línea 15: | Línea 15: | ||
|- |
|- |
||
! Butano<br />n-butano |
! Butano<br />n-butano |
||
| ⚫ | |||
! Metasdadasd xupala |
|||
| ⚫ | |||
|- |
|- |
||
| [[Archivo:Butane.svg|150px|Cadena lineal de 4 átomos de C]] |
| [[Archivo:Butane.svg|150px|Cadena lineal de 4 átomos de C]] |
||
Revisión del 16:34 7 abr 2010
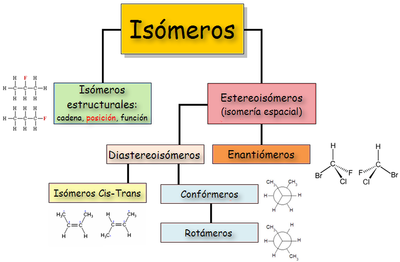
La isomería es una propiedad de ciertos compuestos químicos que con igual fórmula química, es decir, iguales proporciones relativas de los átomos que conforman su molécula, presentan estructuras moleculares distintas y, por ello, diferentes propiedades. Dichos compuestos reciben la denominación de isómeros. Los isómeros son compuestos que tienen la misma fórmula molecular pero diferente fórmula estructural y, por tanto, diferentes propiedades. Por ejemplo, el alcohol etílico o etanol y el éter dimetílico son isómeros cuya fórmula molecular es C2H6O.
Aunque este fenómeno es muy frecuente en Química orgánica, no es exclusiva de ésta pues también la presentan algunos compuestos inorgánicos, como los compuestos de los metales de transición.
Isomería en Química Orgánica
Hay dos tipos básicos de isomería: plana y espacial.[1]
Isomería plana o estructural
En la isomería plana o estructural las diferencias se ponen de manifiesto al representar el compuesto en el plano.
Isomería de cadena u ordenación
| Butano n-butano |
Metilpropano iso-butano ó ter-butano |
|---|---|

|

|
Varía la disposición de los átomos de C en la cadena o esqueleto carbonado, es decir la estructura de éste, que puede ser lineal o tener distintas ramificaciones.
Así, el C4H10 corresponde tanto al butano como al metilpropano (isobutano ó ter-butano):
Para la fórmula C5H12, tenemos tres posibles isómeros de cadena: pentano, metilbutano (isopentano) y dimetilpropano (neopentano). El número de isómeros de cadena crece rápidamente al aumentar el número de átomos de carbono.
Isomería de posición
| CH3-CH2-CH2-CH2OH | CH3-CH2-CHOH-CH3 |
|---|---|
| Butan-1-ol, 1-butanol o n-butanol | Butan-2-ol, 2-butanol o sec-butanol |
La presentan aquellos compuestos que poseen el mismo esqueleto carbonado pero en los que el grupo funcional o el sustituyente ocupa diferente posición.
El C4H10O puede corresponder a dos sustancias isómeras que se diferencian en la posición del grupo OH:
Isomería de función
| CH3-CH2-CH0 | CH3-CO-CH3 |
|---|---|
| Propanal (función aldehído) | Propanona (función cetona) |
Varía el grupo funcional, conservando el esqueleto carbonado.
El C3H6O puede corresponder a:
Esta isomería la presentan ciertos grupos de compuestos relacionados como: los alcoholes y éteres, los acidos y ésteres, y también los aldehídos y cetonas.
Tautomería

Es un tipo especial de isomería en la que existe transposición de un átomo entre las dos estructuras, generalmente hidrógeno,existiendo además un fácil equilibrio entre ambas formas tautómeras[2] Un ejemplo de la misma es la tautomería ceto-enólica en la que existe equilibrio entre un compuesto con grupo OH unido a uno de los átomos de carbono de un doble enlace C=C, y un compuesto con el grupo carbonilo intermedio, C=O típico de las cetonas, con transposición de un átomo de hidrógeno.
Isomería espacial o estereoisomería
Presentan estereoisomería aquellos compuestos que tienen fórmulas moleculares idénticas y sus átomos presentan la misma distribución (la misma forma de la cadena; los mismos grupos funcionales y sustituyentes; situados en la misma posición), pero su disposición en el espacio es distinta.
Los isómeros tienen igual forma en el plano. Es necesario representarlos en el espacio para visualizar las diferencias. Puede ser de dos tipos: isomería conformacional e isomería configuracional, según que los isómeros se puedan convertir uno en otro por simple rotación de enlaces simples, o no.
Isomería conformacional


En este tipo de isómeros conformacionales[3] o confórmeros, la conversión de una forma en otra es posible pues la rotación en torno al eje de los átomos de carbono es más o menos libre (ver animación a la derecha). Por eso también reciben el nombre de rotámeros. Si los grupos son voluminosos podría haber impedimento estérico y no ser tan fácil la interconversión entre rotámeros.
Estas formas se reconocen bien si utilizamos la proyección de Newman, como se aprecia en los dibujos de la izquierda. Reciben nombres como sinclinal (a veces, gauche), anticlinal (anti o trans), sinperiplanar y antiperiplanar.[3]
Otro tipo de isómeros conformacionales se da en compuestos con ciclos hexagonales,como el ciclohexano, donde son factibles la conformación en forma de silla y conformación en forma de bote.
Isomería configuracional
No basta una simple rotación para convertir una forma en otra y aunque la disposición espacial es la misma,los isómeros no son interconvertibles. Se divide en: isomería geométrica o cis-trans, e isomería óptica.
Isomería geométrica o cis-trans
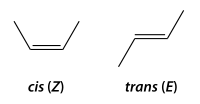
Se produce cuando hay dos carbonos unidos con doble enlace que tienen las otras valencias con los mismos sustituyentes (2 pares) o con dos iguales y uno distinto.
No se presenta isomería geométrica ligada a los enlaces triples o sencillos.
A las dos posibilidades se las denomina:
- forma cis (o forma Z), con los dos sustituyentes más voluminosos del mismo lado, y
- forma trans (o forma E), con los dos sustituyentes más voluminosos en posiciones opuestas.
No se pueden interconvertir entre sí estas dos formas de un modo espontáneo, pues el doble enlace impide la rotación, aunque sí pueden convertirse a veces, en reacciones catalizadas.
| Isómeros del But-2-eno | Ácido maleico (Cis) y ácido fumárico (trans) |
Formas trans (E) y cis (Z) del 1,2-dibromoeteno. |
|---|---|---|

|
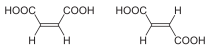
|

|
La isomería geométrica también se presenta en compuestos con doble enlace N=N, o en compuestos cíclicos en los que también se impide la rotación en torno a un eje.
| 1,2-dimetilciclopentano (formas cis y trans) |
cis-1,2-diclorociclohexano | trans-1,2-diclorociclohexano | Formas cis y trans del difluorodiazeno |
|---|---|---|---|

|

|

|

|
Isomería óptica o Enantiomería
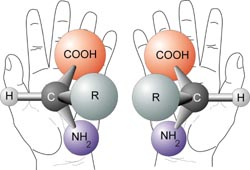
Cuando un compuesto tiene al menos un átomo de Carbono asimétrico o quiral, es decir, un átomo de carbono con cuatro sustituyentes diferentes, pueden formarse dos variedades distintas llamadas estereoisómeros ópticos, enantiómeros, formas enantiomórficas o formas quirales, aunque todos los átomos están en la misma posición y enlazados de igual manera. Esto se conoce como regla de Level y Van't Hoff.[1]
Los isómeros ópticos no se pueden superponer y uno es como la imagen especular del otro, como ocurre con las manos derecha e izquierda. Presentan las mismas propiedades físicas y químicas pero se diferencian en que desvían el plano de la luz polarizada en diferente dirección: uno hacia la derecha (en orientación con las manecillas del reloj) y se representa con la letra (D) o el signo (+)(isómero dextrógiro o forma dextro) y otro a la izquierda (en orientación contraria con las manecillas del reloj)y se representa con la letra (L) o el signo (-)(isómero levógiro o forma levo).[4]

Si una molécula tiene n átomos de Carbono asimétricos, tendrá un total de 2n isómeros ópticos.
También pueden representarse estos isómeros con las letras (R) y (S). Esta nomenclatura se utiliza para determinar la configuración absoluta de los carbonos quirales.
Así pues,hay tres sistemas de nombrar estos compuestos: según la dirección de desviación del plano de la luz polarizada (Formas + y -); según la configuración (Formas D y L) y según la configuración absoluta (formas R y S).
Diasteroisómeros
Cuando un compuesto tiene más de un carbono asimétrico podemos encontrar formas enatiómeras (que son imagen especular una de la otra) y otras formas que no son exactamente copias espaculares, por no tener todos sus carbonos invertidos. A estas formas se les llama diasteroisómeros. Por ejemplo, el 3-bromo-butan-2-ol posee dos carbonos asimétricos por lo que tiene 4 formas posibles. De ellas, algunas son enantiomorfas (formas especulares), como (2S,3S)-3-bromo-butan-2-ol y (2R,3R)-3-bromo-butan-2-ol. En cambio, (2R,3S)-3-bromo-butan-2-ol es un diastereoisómero de los dos anteriores.
Mezcla racémica y formas meso

Una mezcla racémica es la mezcla equimolecular de los isómeros dextro y levo. Esta fórmula es ópticamente inactiva (no desvía el plano de la luz polarizada). La mezcla de ácido D-láctico y L-láctico forma una mezcla racémica, ópticamente inactiva.
Si un compuesto posee dos carbonos asimétricos, puede tener uno dextrógiro y otro levógiro, pero si tiene un plano de simetría, en conjunto se comporta como ópticamente inactivo y recibe el nombre de forma meso. Es el caso del ácido tartárico o 2,3-dihidroxibutanodioico, uno de cuyos isómeros es una forma meso.
Poder rotatorio específico Es la desviación que sufre el plano de polarización al atravesar la luz polarizada una disolución con una concentración de 1 gramo de sustancia por cm³ en un recipiente de 1 dm de anchura. Es el mismo para ambos enantiómeros, aunque de signo contrario. Se mide con el polarímetro.[5]
Isomería en Química Inorgánica
Hay varios tipos de isomeria presente en compuestos inorgánicos, sobre todo en complejos de coordinación,[6] pero este fenómeno no es tan importante como en química orgánica:
- Isomería estructural o topológica: Los átomos se unen de modo diferente, como en el S2F2, de los que existe una molécula en forma de cadena y otra en forma de pirámide triangular. Un caso especial es la tautomería, en la que un átomo de H cambia de posición.
- Isomería conformacional: Igual a la ya comentada para compuestos orgánicos. Se presenta en compuestos con enlace sencillo como P2H4 o el ión ditionito, S2O42-, donde existen formas eclipsadas, escalonadas y sinclinal (gauche).
- Isomería cis-trans (geométrica): Aparece en compuestos como el ácido nitroso, HNO2, o en complejos de coordinación plano-cuadrados como [PtCl2(NH3)2].
- Isomería de posición, como en algunos heterociclos de azufre y nitrógeno. En el S6(NH)2 se mantiene el anillo octogonal del azufre pero dos átomos de azufre han sido sustituidos por grupos NH,que pueden estar en posición 1,2; 1,3; 1,4 y 1,5.
- Isomería óptica: también aparece en compuestos de coordinación de estructura tetraédrica con sustituyentes diferentes.
- Isomería de ionización: Se intercambian un ligando del catión con uno delos aniones que loneutralizan,como ocurre entre [CrSO4(NH3)5]Cl y [CrCl(NH3)5]SO4
- Isomería de coordinación: Si ambos iones son complejos, podemos intercambiar sus ligandos y obtendremos isómeros diferentes, como ocurre entre [Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6].

Isomería de enlace en un complejo de Cobalto - Isomería de enlace: Algunos ligandos pueden unirse de modo diferente al ión central,como ocurre en [CoCl(NO2)(NH3)4]+ [CoCl(ONO)(NH3)4]+[7]
- Isomería de polimerización: Es el caso de NO2 y N2O4, dos óxidos de nitrógeno gaseosos.
Referencias
- ↑ a b Química: Teoría y problemas. José Antonio García Pérez y otros. Ed. Tébar Flores. Albacete, 1996. ISBN:8473601559 .Pág. 253 y ss.
- ↑ Química orgánica. Robert Thornton Morrison, Robert Neilson Boyd. 5ª ed., Editorial Pearson Educación, 1998. ISBN: 9684443404. Pág. 421
- ↑ a b Título Fundamentos de química orgánica. Carl David Gutsche. Editorial Reverté, 1979. ISBN: 8429174753. Pág.67
- ↑ Química general; 8ª edición; Petrucci, Harwood y Herring; Prentice Hall; ISBN:0-13-014329-4
- ↑ Química orgánica básica y aplicada: de la molécula a la industria, Volumen 1. Eduardo Primo Yúfera. Editorial Reverté, 1996. ISBN: 8429179534, Pág. 52 y ss.
- ↑ http://books.google.es/books?id=8QMxhRyAOGYC&pg=PA48&dq=isomer%C3%ADa+en+qu%C3%ADmica+inorg%C3%A1nica&as_brr=0&cd=2#v=onepage&q=isomer%C3%ADa%20en%20qu%C3%ADmica%20inorg%C3%A1nica&f=false Química inorgánica estructural.] A.F. Wells. Editorial Reverté, 1978. ISBN: 8429175245. Pág. 48 y ss.
- ↑ http://www.textoscientificos.com/quimica/inorganica/metales-transicion/isomeria Isomería en TextosCientíficos.com
Enlaces externos
- Isomería Página en Averroes
- Isomería:tipos. Universidad de Huelva

