Diferencia entre revisiones de «Alcohol»
m Revertidos los cambios de 166.238.84.46 (disc.) a la última edición de Tirithel |
|||
| Línea 65: | Línea 65: | ||
*''Alcohol secundario'': se obtiene una cetona + agua |
*''Alcohol secundario'': se obtiene una cetona + agua |
||
*''Alcohol terciario'': si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano. |
*''Alcohol terciario'': si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano. |
||
=== Deshidratación de alcoholes === |
=== Deshidratación de alcoholes === |
||
Revisión del 00:38 13 oct 2009

En química se denomina alcohol (del árabe al-khwl الكحول, o al-ghawl الغول, "el espíritu", "toda sustancia pulverizada", "líquido destilado") (ver origen del término en la desambiguación) a aquellos hidrocarburos saturados, o alcanos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno enlazado de forma covalente.
Los alcoholes pueden ser primarios, secundarios o terciarios, en función del número de átomos de hidrógeno sustituidos en el átomo de carbono al que se encuentran enlazado el grupo hidroxilo.
A nivel del lenguaje popular se utiliza para indicar comúnmente una bebida alcohólica, que presenta etanol.
Su formula química es CH3CH2OH.
Historia
La palabra alcohol proviene del árabe «al» (el) y «kohol» que significa «sutil».
Los árabes conocieron el alcohol extraído del vino por destilación. Sin embargo su descubrimiento se hace remontar a principios del siglo XIV, atribuyéndose al médico Arnau de Villanova, sabio alquimista y profesor de medicina en Montpellier. La quinta esencia de Raimundo Lulio no era otra cosa que el alcohol rectificado a una más suave temperatura. Lavoisier fue quien dio a conocer el origen y la manera de producirse el alcohol por medio de la fermentación vínica, demostrando que bajo la influencia de la levadura de cerveza el azúcar de uva se transforma en ácido carbónico y alcohol. Fue además estudiado por Scheele, Gehle, Thénard, Duma y Boullay y en 1854 Berthelot lo obtuvo por síntesis.[1]
Otros ejemplos
Propanotriol, glicerol o glicerina:
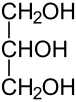
Química
Nomenclatura
- Común (no sistemática): anteponiendo la palabra alcohol y sustituyendo el sufijo -ano del correspondiente alcano por -ílico. Así por ejemplo tendríamos alcohol metílico, alcohol etílico, alcohol propílico, etc.
- IUPAC: sustituyendo el sufijo -ano por -ol en el nombre del alcano progenitor, e identificando la posición del átomo del carbono al que se encuentra enlazado el grupo hidroxilo.
- Cuando el grupo alcohol es sustituyente, se emplea el prefijo hidroxi-
- Se utilizan los sufijos -diol, -triol... según la cantidad de grupos OH que se encuentre.
Formulación
Los monoalcoholes derivados de los alcanos responden a la fórmula general CnH2n+1OH
Propiedades generales
Los alcoholes son líquidos incoloros de baja masa molecular y de olor característico, solubles en el agua en proporción variable y menos densos que ella. Al aumentar la masa molecular, aumentan sus puntos de fusión y ebullición, pudiendo ser sólidos a temperatura ambiente (p.e. el pentaerititrol funde a 260 ºC). También disminuye la solubilidad en agua al aumentar el tamaño de la molécula, aunque esto depende de otros factores como la forma de la cadena alquílica. Algunos alcoholes (principalmente polihidroxílicos y con anillos aromáticos) tienen una densidad mayor que la del agua. Sus puntos de fusión y ebullición suelen estar muy separados, por lo que se emplean frecuentemente como componentes de mezclas anticongelantes. Por ejemplo, el 1,2-etanodiol tiene un p.f. de -16 ºC y un p.eb. de 197 ºC.
Propiedades químicas de los alcoholes:
Las propiedades químicas de los alcoholes están relacionados con el grupo -OH, que es muy polar y capaz de establecer puentes de hidrógeno con sus moléculas compañeras, con otras moléculas neutras, y con aniones.
Fuentes
Muchos alcoholes pueden ser creados por fermentación de frutas o granos con levadura, pero solamente el etanol es producido comercialmente de esta manera, principalmente como combustible y como bebida. Otros alcoholes son generalmente producidos como derivados sintéticos del gas natural o del petróleo.
Usos
Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica.
Alcohol de botiquín
El alcohol de botiquín puede tener varias composiciones. Puede ser totalmente alcohol etílico al 96º, con algún aditivo como el cloruro de benzalconio o alguna sustancia para darle un sabor desagradable. Es lo que se conoce como alcohol etílico desnaturalizado.
Si contiene solo etanol, se podría llegar a beber con los mismos efectos que una bebida alcohólica. De hecho, en Suecia para comprar alcohol en un farmacia se necesita receta médica, para controlar a los que podrían bebérselo.[cita requerida]
Otras composiciones: podría contener alcohol isopropílico, no es apto para beberlo, pero puede ser más efectivo para el uso como secante.
Habitualmente el alcohol etílico tiene una concentración de 96º, sin embargo, para uso como desinfectante, es más efectivo si esta rebajado hasta una concentración de 70º.[cita requerida]
Alcoholes primarios, secundarios y terciarios
- Alcohol primario: los alcoholes primarios reaccionan muy lentamente. Como no pueden formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ión cloruro. Con un alcohol primario, la reacción puede tomar desde treinta minutos hasta varios días.
- Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 20 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
- Alcohol terciario: los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables.
Oxidación de alcoholes
- Alcohol primario: se utiliza la Piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico
- Alcohol secundario: se obtiene una cetona + agua
- Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
Deshidratación de alcoholes
La deshidratación de alcoholes es el proceso químico que consiste en la conversión de un alcohol en un alqueno por proceso de eliminación. Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el OH el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en remplazo.
Por esto, la deshidratación de alcoholes útil, puesto que fácilmente convierte a un alcohol en un alqueno.
Un ejemplo simple es la síntesis del ciclohexeno por deshidratación del ciclohexanol. Se puede ver la acción del ácido (H2SO4) ácido sulfúrico el cual quita el grupo hidroxilo del alcohol, generando el doble enlace y agua.
Véase también
Enlaces externos
 Wikiquote alberga frases célebres de o sobre Alcohol.
Wikiquote alberga frases célebres de o sobre Alcohol. Wikimedia Commons alberga una galería multimedia sobre Alcohol.
Wikimedia Commons alberga una galería multimedia sobre Alcohol.- Consumo de alcohol, salud y sociedad, resumen realizado por GreenFacts de un informe de la OMS
Referencias
- ↑ Diccionario enciclopédico popular ilustrado Salvat (1906-1914)
- Este artículo es una obra derivada de «Las drogas tal cual...» por Karina Malpica, publicada en mindsurf. Texto reproducido con la autorización de la autora bajo la licencia GNU Free Documentation License.
