Óxido perclórico
Apariencia
| Óxido perclórico | ||
|---|---|---|
 | ||
| General | ||
| Fórmula estructural |
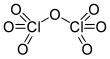 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 12015-53-1[1] | |
| ChEBI | 52356 | |
| ChemSpider | 109884 | |
| PubChem | 123272 | |
| UNII | 22MM1X86NB | |
| Propiedades físicas | ||
| Masa molar | 181.902108 y 181.9021077 g/mol | |
El óxido perclórico, también llamado óxido de cloro (VII), anhidrido perclórico, heptoxido de dicloro, es un compuesto químico inorgánico cuya fórmula es: Cl2O7
Es considerado como uno de los óxidos de cloro más estables, y el que está más oxigenado. Cuando reacciona con agua produce ácido perclórico.[2][3][4]
Propiedades físicas y químicas del óxido perclórico
[editar]Las principales propiedades físicas y químicas del óxido perclórico son:[2]
- líquido incoloro volátil y aceitoso,
- peso molecular es de 182,9 g/mol,
- densidad de 1900 kg/m³
- puntos de fusión y de ebullición -91,57 °C y 82 °C respectivamente,
- espontáneamente explosivo al impacto o en contacto con la llama y especialmente en presencia de sus productos de descomposición,
- soluble en tetracloruro de carbono a temperatura ambiente,
- reacciona con agua para formar ácido perclórico,
- estalla al contacto con el yodo,
- en condiciones normales, es más estable, aunque con menos poder oxidante que los otros óxidos de cloro,
- óxido fuertemente ácido, y en solución forma un equilibrio con el ácido perclórico,
- en presencia hidróxidos de metales alcalinos, forma percloratos,
- su descomposición térmica se produce por la disociación monomolecular del trióxido de cloro y radical.
Referencias
[editar]- ↑ Número CAS
- ↑ a b «Óxido perclórico: fórmula, propiedades, riesgos y usos - Lifeder». Lifeder. 4 de julio de 2017. Consultado el 16 de mayo de 2018.
- ↑ «Cl2O7 / óxido de cloro (VII)». www.formulacionquimica.com. Consultado el 16 de mayo de 2018.
- ↑ «perclórico». TheFreeDictionary.com. Consultado el 16 de mayo de 2018.
